
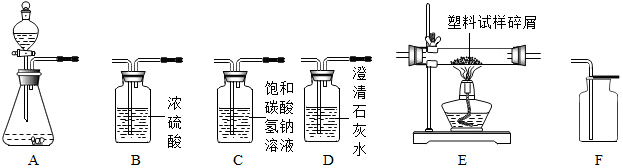
分析 (1)①根据实验室用浓盐酸和石灰石制取的二氧化碳中混有氯化氢、水蒸气,硝酸银会与盐酸反应,浓硫酸有吸水性,除去水蒸气需要放在最后,二氧化碳的密度比空气大进行分析;
②根据碳酸钙和盐酸反应生成氯化钙、水和二氧化碳进行分析;
③根据二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水进行分析;
(2)①根据过氧化氢在二氧化锰的催化作用下分解生成水和氧气进行分析;
②根据浓硫酸具有吸水性,仪器B2质量增加3.6g就是水的质量,依据水中氢元素的质量分数计算出氢元素的质量,然后计算氢元素的质量分数;
③根据仪器B1是吸收过氧化氢分解生成的水,没有连接仪器B1时,仪器B2吸收的水的质量会偏大,测算出的该塑料试样中H元素的质量与实际值比较将偏大进行分析.
解答 解:(1)①实验室用浓盐酸和石灰石制取的二氧化碳中混有氯化氢、水蒸气,硝酸银会与盐酸反应,浓硫酸有吸水性,除去水蒸气需要放在最后,二氧化碳的密度比空气大,所以所选仪器的连接顺序为ACBF;
②碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑;
③二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水,所以检验集气瓶中气体是否为二氧化碳的具体方法是:倒入澄清石灰水,若石灰水变浑浊,则收集到的气体为二氧化碳;
(2)①过氧化氢在二氧化锰的催化作用下分解生成水和氧气,化学方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
②浓硫酸具有吸水性,仪器B2质量增加3.6g就是水的质量,该塑料试样中H元素的质量分数为:$\frac{\frac{2}{18}×3.6g}{3.5g}$×100%=11.4%;
③仪器B1是吸收过氧化氢分解生成的水,没有连接仪器B1时,仪器B2吸收的水的质量会偏大,测算出的该塑料试样中H元素的质量与实际值比较将偏大.
故答案为:(1)①ACBF;
②CaCO3+2HCl=CaCl2+H2O+CO2↑;
③倒入澄清石灰水,若石灰水变浑浊,则收集到的气体为二氧化碳;
(2)①2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
②11.4%;
③偏大.
点评 本题主要考查常见气体的发生装置与收集装置的探究,发生装置依据反应物的状态和反应条件选择,收集装置依据气体的密度和溶解性选择.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:推断题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 生石灰、氧化钙、CaO | B. | 纯碱、氢氧化钠、NaOH | ||
| C. | 石灰石、氢氧化钙、Ca(OH)2 | D. | 熟石灰、碳酸钙、CaCO3 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 铁生锈 | B. | 蜡烛燃烧 | C. | 加热高锰酸钾 | D. | 工业制取氧气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com