
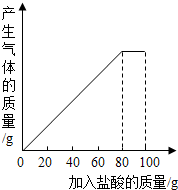
 有一种石灰石样品的成分是CaCO3和SiO2.课外小组同学将100g盐酸分5次加入到35g石灰石样品中(已知SiO2不与盐酸反应,也不溶于水),得到如下部分数据和图象.
有一种石灰石样品的成分是CaCO3和SiO2.课外小组同学将100g盐酸分5次加入到35g石灰石样品中(已知SiO2不与盐酸反应,也不溶于水),得到如下部分数据和图象.| 次数 | 第1次 | 第2次 | 第3次 |
| 加入盐酸的质量/g | 20 | 20 | 20 |
| 剩余固体的质量/g | 30 | a | 20 |
分析 (1)由图表分析,三次参加反应的物质质量相等,由此计算出第二次参加反应的物质质量,再由剩余固体的质量=总质量-参加反应的物质质量可计算出a的值;
(2)根据题意和图表分析,可得到样品中CaCO3的质量,再根据CaCO3中钙元素、碳元素和氧元素的质量计算出它们各占的比值;
(3)利用第四次反应恰好反应完全以及方程式可以计算反应的氯化氢的质量,进而计算盐酸的溶质质量分数.
解答 解:(1)由图象可知,第四次加入盐酸后,才得到完全反应,故在反应过程中,第一次充分反应后剩余固体的质量为30g,说明只有35g-30g=5g样品参与了反应,第三次充分反应后剩余固体的质量为20g,说明共有35g-20g=15g样品参与了反应,故第二次充分反应时,也只有5g样品参与了反应,故第2次加入盐酸后,a为35g-5g×2=25g;
(2)根据图象分析,第4次加入盐酸后,样品中CaCO3完全反应.
样品中钙元素、碳元素和氧元素的质量比:
20g×$\frac{40}{100}$:20g×$\frac{12}{100}$:(20g×$\frac{48}{100}$+15g×$\frac{32}{60}$)=10:3:22
(3)由图象可知在加入80g稀盐酸即第4次加入后,恰好反应完全,故第4次加入稀盐酸后,固体物质总共减少的质量=5g×4=20g,及样品中碳酸钙的质量是20g,设20g碳酸钙完全反应的氯化氢质量是x,
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73
20g y
$\frac{100}{20g}=\frac{73}{y}$
x=14.6g
盐酸的溶质质量分数为:$\frac{14.6g}{80g}$×100%=18.3%
答案:
(1)25;
(2)10:3:22;
(3)盐酸的溶质质量分数为18.3%;
点评 本题要求学生了解完全反应和不完全反应的概念及特点,观察图表,分析数据,正确解答.


科目:初中化学 来源: 题型:解答题
 目前,市场上出现的木糖醇(化学式为C5H12O5)是一种新型甜味剂.试回答下列问题:
目前,市场上出现的木糖醇(化学式为C5H12O5)是一种新型甜味剂.试回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | Fe2+、Cu2+ | B. | Cu2+、H+ | C. | Zn2+、Fe2+、H+ | D. | Zn2+、Fe2+ |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
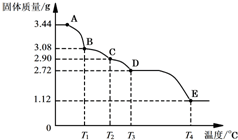 CaSO4•2H2O受热会逐步失去结晶水.取纯净的CaSO4•2H2O固体3.44g进行加热,测定固体质量随温度的变化情况如图所示.C点固体的化学式是2CaSO4•H2O.T3~T4温度段加热固体所产生的气体是形成酸雨的主要物质之一,则D~E段发生反应的化学方程式为2CaSO4$\frac{\underline{\;高温\;}}{\;}$2CaO+2SO2↑+O2↑.
CaSO4•2H2O受热会逐步失去结晶水.取纯净的CaSO4•2H2O固体3.44g进行加热,测定固体质量随温度的变化情况如图所示.C点固体的化学式是2CaSO4•H2O.T3~T4温度段加热固体所产生的气体是形成酸雨的主要物质之一,则D~E段发生反应的化学方程式为2CaSO4$\frac{\underline{\;高温\;}}{\;}$2CaO+2SO2↑+O2↑.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
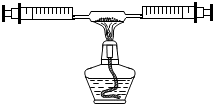 某课外活动小组在学习了书本“空气中氧气含量的测定”实验,知道P2O5不能随便排放在空气中,否则会对空气造成污染,所以对该实验进行了改进:
某课外活动小组在学习了书本“空气中氧气含量的测定”实验,知道P2O5不能随便排放在空气中,否则会对空气造成污染,所以对该实验进行了改进:| 反应前注射器内气体总体积 | 反应后注射器内气体总体积 |
| 50mL | 42mL |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com