
【题目】已知某种治疗胃病药品的主要成份是铝碳酸镁片,化学式为AlaMgb(OH)16CO3·4H2O,假设药品中的其它成份受热不分解、不溶于水且不与稀硫酸反应.某研究性学习小组设计了如下实验探究铝碳酸镁片的组成.

【实验一】取m g该药片,研成粉末放入硬质玻璃管中,加热,充分反应后测得装置C增重2.16g,装置D增重0.44g.
(1)铝碳酸镁片加热分解的产物为Al2O3、MgO、CO2和水,则为分别测定CO2和水的质量,装置C和D中盛放的药品应选择:C , D (填序号).
①浓硫酸 ②碱石灰 ③氯化钙 ④纯碱
(2)实验开始前先通入一定量空气,其操作方法是关闭弹簧夹 ,打开弹簧夹 ,目的是 .
(3)一段时间后,打开弹簧夹 ,关闭弹簧夹 ,点燃酒精灯加热,充分反应后,停止加热,继续通入空气至玻璃管冷却的目的是 (填序号).
①排净空气防爆炸
②防止空气中水和二氧化碳进入C、D影响测定
③使生成水和二氧化碳进入C、D被充分吸收
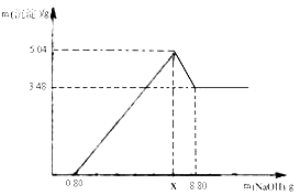
【实验二】另取m g该药片,加入100 g 9.8%的稀硫酸,充分反应后滤去不溶物,得到含有MgSO4和Al2(SO4)3等溶质的滤液,向滤液中逐渐加入足量的稀NaOH溶液,产生沉淀的物质的质量与加入NaOH质量的关系如图.
已知:MgSO4+2NaOH=Mg(OH)2↓+Na2SO4,
Al2(SO4)3+6NaOH=2Al(OH)3↓+3Na2SO4,
Al(OH)3+NaOH=NaAlO2+2H2O,
Mg(OH)2不溶于NaOH,NaAlO2可溶于水.
(1)图中NaOH加入0.80g,仍没有沉淀,说明滤液中含 .当加入NaOH的质量到x时,生成的沉淀有 ,其中Al(OH)3的质量是 g,则x= g.
(2)有医生建议患有严重胃溃疡的患者最好慎用该药,试用你所学的知识解释这样建议的理由是 .
(3)试确定铝碳酸镁的化学式为 .
【答案】【实验一】(1)①②
(2)b;a排尽装置内空气,防止干扰(3)ba③
【实验二】(1)稀硫酸 Al(OH)3 Mg(OH)2 1.56 8
(2)该药在使用过程中会产生气体,严重胃溃疡的患者服用会产生胃穿孔(3)Al2Mg6(OH)16CO3·4H2O
【解析】
试题分析:铝碳酸镁片加热分解的产物为Al2O3、MgO、CO2和水,则为分别测定CO2和水的质量,装置C和D中盛放的药品应选择:C 浓硫酸, D碱石灰,因为浓硫酸具有吸水性,先将水吸收,利用碱石灰能够吸收二氧化碳的性质来获得重生二氧化碳的质量,二者的顺序不能换,因为碱石灰也能将水吸收,实验开始前先通入一定量空气,其操作方法是关闭弹簧夹 b,打开弹簧夹a,目的是排尽装置内空气,防止干扰.一段时间后,打开弹簧夹b,关闭弹簧夹a ,点燃酒精灯加热,充分反应后,停止加热,继续通入空气至玻璃管冷却的目的是使生成水和二氧化碳进入C、D被充分吸收; 图中NaOH加入0.80g,仍没有沉淀,说明滤液中含 稀硫酸.当加入NaOH的质量到x时,生成的沉淀有Al(OH)3 ; Mg(OH)2 ,因为产生沉淀到最大值,由图象分析,NaOH加入0.80g,仍没有沉淀,说明滤液含硫酸,当加入NaOH的质量到x时,生成的沉淀有氢氧化镁和氢氧化铝;图象分析沉淀3.48g为Mg(OH)2,Al(OH)3的质量量为5.04-3.48g=1.56g;
设与硫酸镁反应的氢氧化钠的质量为x,与硫酸铝反应的氢氧化钠的质量为y,x
MgSO4+2NaOH═Mg(OH)2↓+Na2SO4 Al2(SO4)3+6NaOH═2Al(OH)3↓+3Na2SO4
80 58
x 3.48g
列比例式得:80:X=58:3.48克
解得x=4.8g
Al2(SO4)3+6NaOH═2Al(OH)3↓+3Na2SO4
240 156
Y 1.56克
列比例式得:240:Y=156:1.56克
解得y=2.4g
则x=4.8g+2.4g+0.8g=8g;其中Al(OH)3的质量是1.56克g,则x=8g.有医生建议患有严重胃溃疡的患者最好慎用该药,解释这样建议的理由是该药在使用过程中会产生气体,严重胃溃疡的患者服用会产生胃穿孔.根据以上数据铝碳酸镁的化学式为Al2Mg6(OH)16CO34H2O。


科目:初中化学 来源: 题型:
【题目】下列关于金属的说法正确的是
A. 人类使用金属铝的年代早于铜、铁
B. “真金不怕火炼”表明金(Au)在高温条件下也很难与氧气反应
C. 武德合金的熔点高,可用于制造保险丝
D. 将生锈的菜刀浸泡在食盐水中,可除去其表面的铁锈
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】阅读下面科普短文(改编自屠呦呦2015年12月7日瑞典演讲稿)。
很多中药古方都提到了青蒿入药抗疟疾,但当1971年开始从青蒿中提取有效成分时,结果却总是不理想。屠呦呦研究组反复研究中医古籍,其中“青蒿一握,以水两升渍,绞取汁,尽服之”激发了她的灵感。是不是高温下破坏了青蒿中抗疟的有效成分?屠呦呦立即改用乙醚在较低温度下进行提取,成功获得了抗疟有效单体的提纯物质,命名为青蒿素。
完成样品纯化后,通过元素分析、光谱测定、质谱及旋光分析等技术手段,测定相对分子质量为282,得出了青蒿素的化学式。但青蒿素的具体结构是什么样的呢?有机所得专家做了一个定性实验,加入碘化钾后,青蒿素溶液变黄了,说明青蒿素中含有过氧基团;而后专家又通过X射线衍射法等方法,最终确定了青蒿素是含有过氧基的新型倍半萜内酯。

图1.青蒿素结构简式 图2.双氢青蒿素结构简式
(化学式:C15H22O5) (化学式:C15H24O5)
由于自然界中天然青蒿素的资源是有限的,接下来就要把自然界的分子通过人工合成制成药物。在这一过程中,研究组又有一项重大研究成果,获得了青蒿素的衍生物。衍生物之一是双氢青蒿素,它也具有抗疟的疗效,并且更加稳定,水溶性好,比青蒿素的疗效好10倍,进一步体现了青蒿素类药物“高效、速效、低毒”的特点。
依据文章内容,回答下列问题:
(1)从中国古代青蒿入药,到2004年青蒿素类药物被世界卫生组织列为对抗疟疾的首选药物,经历了漫长的历程。将下列三项针对青蒿素的研究按时间先后排序 (填数字序号)。
① 确定结构 ② 分离提纯 ③ 人工合成
(2)屠呦呦用乙醚提取青蒿素,获得成功的关键在于改变了哪种条件: 。
(3)青蒿素分子中碳、氢、氧原子个数比为 。
(4)向无色的双氢青蒿素溶液中加入碘化钾,实验现象为 。
(5)根据上述文字介绍,下列说法正确的是 (填字母序号)。
A.确定了青蒿素的组成元素,由此就可以确定青蒿素的化学式
B.青蒿素是含有过氧基的新型倍半萜内酯
C.由于自然界中有青蒿,因此我们应用青蒿素时只需从青蒿中提取即可
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是配制溶质质量分数为10%的NaCl溶液的实验操作示意图:
![]()

(1)用上图表示的序号表示配制溶液的正确操作顺序 。
(2)图②中用来取用NaCl的仪器是 。
(3)称量NaCl时,天平平衡后的状态如图⑤所示,游码标尺示数见右上图,则称取的NaCl质量为 g。
(4)称量NaCl质量完毕放回砝码时,发现有一个砝码缺损了一个小角,若其他操作步骤正确,则所配溶液的溶质质量分数 (填“大于”、“小于”或“等于”)10%。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某兴趣小组的同学用生铁制成的铁钉来制取晶体【FeSO4·7H2O】,进行了如下实验:

(1)操作1、2中所用的玻璃仪器有玻璃棒、烧杯、胶头滴管和 .
(2)混合溶液A中的溶质有Fe2(SO4)3、H2SO4和 (化学式).
(3)操作3的步骤是加热浓缩、 、过滤、洗涤、干燥.
(4)洗涤【FeSO4·7H2O】晶体可下列试剂 .
A.水 B.稀硫酸 C.冷水
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据下图回答问题:

(1)仪器a和b的名称分别是 、 。
(2)实验室若用A装置来制取氧气,反应的化学方程式为 ,你选用的一种收集装置是 (填字母,下同),选择的理由是 。
(3)在实验室里,可用亚硫酸钠(Na2SO3)固体和稀硫酸的反应来制取SO2气体,该反应的化学方程式为 。在通常情况下SO2是一种无色、有刺激性气味的有毒气体,能溶于水且水溶液呈酸性。实验室制取并收集纯净干燥的SO2(在通风橱中进行)应选用的装置组合是 。收集好后,多余的SO2气体可用F装置来吸收,此时应把里面浓硫酸换成 溶液。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com