

分析 根据题干提供的信息进行分析,捕捉室中含有氢氧化钠溶液,氢氧化钠能与二氧化碳反应生成碳酸钠和水;氧化钙能与水反应生成氢氧化钙,氢氧化钙能与碳酸钠反应生成碳酸钙沉淀和氢氧化钠,碳酸钙可以高温分解生成氧化钙和二氧化碳,进行分析.
解答 解:(1)由题意可知,碳酸钠与氢氧化钙反应生成了的氢氧化钠和碳酸钙高温分解的氧化钙是可以循环利用的;
(2)在“反应分离”中发生的反应有CaO+H2O=Ca(OH)2,Ca(OH)2+Na2CO3=CaCO3↓+2NaOH,所以分离CaCO3和NaOH用过滤操作;
(3)在“反应分离”中发生的反应有CaO+H2O=Ca(OH)2,Ca(OH)2+Na2CO3=CaCO3↓+2NaOH,其中Ca(OH)2+Na2CO3=CaCO3↓+2NaOH属于复分解反应;
“高温反应炉”内发生反应是碳酸钙高温分解生成氧化钙和二氧化碳,反应的化学方程式是:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑;
故答案为:(1)氢氧化钠、氧化钙;(2)过滤;(3)Ca(OH)2+Na2CO3=CaCO3↓+2NaOH;CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑.
点评 本题考查了减少二氧化碳排放的方法,完成此题,可以依据已有的物质的性质进行.


科目:初中化学 来源: 题型:选择题
| A. | 2Fe+6HCl═2FeCl3+3H2↑ | B. | 2Al+3CuCl2═2AlCl3+3Cu | ||
| C. | Mg+2AgCl═MgCl2+2Ag | D. | BaCl2+Mg(NO3)2═Ba(NO3)2↓+MgCl2 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
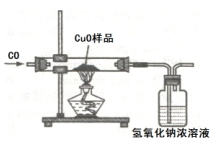 金属的冶炼时,某学习小组用如图所示的装置测量氧化铜样品中氧化铜的质量分数,实验所取氧化铜样品质量为10克.(所含杂质不参加反应)
金属的冶炼时,某学习小组用如图所示的装置测量氧化铜样品中氧化铜的质量分数,实验所取氧化铜样品质量为10克.(所含杂质不参加反应)查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 氘原子和氚原子属于不同种元素 | |
| B. | 氦原子核内含2个电子 | |
| C. | 氚原子中有一个电子 | |
| D. | 氘原子和氚原子的原子质量分别为2和3 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com