
| A.样品中可能含有NaCl | B.稀盐酸溶质的质量分数是7.3% |
| C.样品中一定含有MgCO3 | D.样品中肯定不含有Na2CO3 |


科目:初中化学 来源:不详 题型:计算题
| ××牌口服液 主要成分:葡萄糖酸锌 化学是:C12H22O14Zn 每只口服液含葡萄糖酸锌45.5mg ××制药厂 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题


查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题
| 物质 | 乙醇 | 氧气 | 水 | 二氧化碳 | X |
| 反应前质量/g | 4.6 | 8.0 | 0 | 0 | 0 |
| 反应后质量/g | 0 | 0 | 5.4 | 4.4 | a |
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
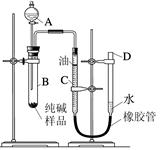
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com