
分析 铁粉在稀硫酸中反应能生成硫酸亚铁和氢气,铁粉与盐酸反应放出氢气,恰好完全反应后所得溶液为氯化亚铁溶液;根据质量守恒定律,由反应前后物质的质量差可计算反应放出氢气质量,利用化学方程式,由氢气质量可计算铁粉质量.
解答 解:生成H2的质量为15g+100g-114.6g=0.4g,
设反应的铁的质量为x,
Fe+H2SO4═FeSO4+H2↑
56 2
x 0.4g
则$\frac{56}{2}=\frac{x}{0.4g}$,解得x=11.2g
则反应后剩余铁的质量15g-11.2g=3.8g
故答案为:3.8g
点评 利用质量守恒定律,根据反应前后质量差计算出放出氢气质量为解决问题的出发点.


科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
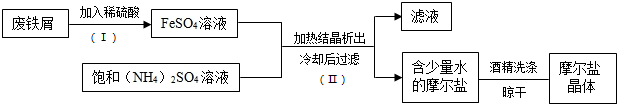

查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 当今,染发已经成为一种时尚,年轻人可以随自己的心情和喜好改变头发的颜色,给人眼前一亮的感觉.但是它在给予我们美丽的同时,会对我们的健康造成伤害,染发剂中的染料具有一定的毒性、刺激性和过敏性.例如,染发剂中普遍含有对苯二胺(其化学式为C6H8N2)会使易过敏的人引起发痒、水肿、气喘、胃炎和贫血等症状,另外它还具有致癌作用.因此,科学界告诫我们:慎用染发剂,少染发为好.
当今,染发已经成为一种时尚,年轻人可以随自己的心情和喜好改变头发的颜色,给人眼前一亮的感觉.但是它在给予我们美丽的同时,会对我们的健康造成伤害,染发剂中的染料具有一定的毒性、刺激性和过敏性.例如,染发剂中普遍含有对苯二胺(其化学式为C6H8N2)会使易过敏的人引起发痒、水肿、气喘、胃炎和贫血等症状,另外它还具有致癌作用.因此,科学界告诫我们:慎用染发剂,少染发为好.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 市场上有一些充气包装的食品(如图).装食品的塑料袋内充满了气体,气体充得鼓鼓的,看上去好像一个小“枕头”.袋内充的是什么气体呢?
市场上有一些充气包装的食品(如图).装食品的塑料袋内充满了气体,气体充得鼓鼓的,看上去好像一个小“枕头”.袋内充的是什么气体呢?查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com