已知有如下反应:A+B→C+D.(答题时需注明必要的反应条件)
(1)若A为Al、B为ZnSO4(溶液),C、D的化学式分别是 、
(2)若A为Fe2O3,写出一个可能的化学方程式
(3)若A为H2、C为H2O,则该反应的化学方程式是 .
(4)若反应为A+2NaOH=C+Cu (OH )2↓,则A和C的相对分子质量之差为 .
【答案】
分析:(1)若A为Al、B为ZnSO
4(溶液),已知有反应:A+B→C+D,铝的金属活动性比锌的强,则发生置换反应,故可知生成物;
(2)若A为Fe
2O
3,已知有反应:A+B→C+D,由题意,B可以为一氧化碳、碳、氢气、稀盐酸、稀硫酸等物质;
(3)若A为H
2、C为H
2O,已知有反应:A+B→C+D,由题意,知B可为氧化铁或氧化铜等物质;
(4)若反应为A+2NaOH=C+Cu (OH )
2↓,根据质量守恒定律,A+80=C+98,故可知A和C的相对分子质量之差.
解答:解:(1)铝的金属活动性比锌的强,则发生置换反应,故可知生成物为Zn;Al
2(SO
4)
3,也可Al
2(SO
4)
3和Zn;
(2)由题意,B可以为一氧化碳、碳、氢气、稀盐酸、稀硫酸等物质,任意选已知书写化学方程式:Fe
2O
3+6HCl=2FeCl
3+3H
2O;
(3)由题意,知B可为氧化铁或氧化铜等物质,任意选已知书写化学方程式:H
2+CuO
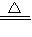
Cu+H
2O;
(4)由A+2NaOH=C+Cu (OH )
2↓,再根据NaOH、Cu (OH )
2的相对分子质量分别为40,98,故根据质量守恒定律,代入相对分子质量,得A+80=C+98,故可知A和C的相对分子质量之差为18.
故答为:(1)Zn;Al
2(SO
4)
3[或Al
2(SO
4)
3和Zn]; (2)Fe
2O
3+6HCl=2FeCl
3+3H
2O; (3)H
2+CuO
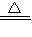
Cu+H
2O;
(4)18(其他合理答案给分)
点评:掌握相对分子质量的概念及其计算,了解有关化学式的计算和推断,掌握质量守恒定律及其应用.

 Cu+H2O;
Cu+H2O; Cu+H2O;
Cu+H2O;

 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案