
| NaHCO3 | Na2CO3 | |
| 加人稀盐酸 | 现象Ⅰ | 产生气泡 |
| 加人饱和石灰水 | 溶液变浑浊 | 现象Ⅱ |
| 加人CaCl2溶液 | 无明显现象 | 溶液变浑浊 |
| 加热溶液至沸腾,将气体通入澄清石灰水 | 澄清石灰水变浑浊 | 澄清石灰水无明显变化 |
| 实验步骤 | 实验现象 | |
| ①取少量样品溶于水,加人过量 的CaCl2溶液. | 有白色沉淀产生 | 该反应的方程式:Na2CO3+CaCl2═CaCO3↓+2NaCl |
| ②将上述反应后的混合液过滤,取滤液. | 有气泡冒出 | 证明猜想②成立. |
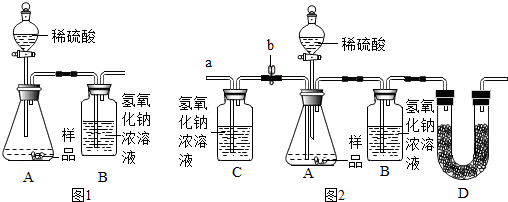
分析 查阅资料:(1)稀盐酸可以和碳酸氢钠反应生成气体,可以据此解答该题;
(2)碳酸钠可以和氢氧化钙溶液反应生成碳酸钙沉淀和氢氧化钠,可以据此写出该反应的化学方程式;
实验探究:碳酸钠可以和氯化钙溶液反应生成碳酸钙沉淀和氯化钠,可以据此写出该反应的化学方程式;碳酸氢钠和盐酸反应生成二氧化碳气体,可以据此完成实验现象;
实验反思:碳酸钠也可以和稀盐酸反应生成气体,为了防止碳酸钠干扰实验现象,所以应该加入过量的氯化钙将碳酸钠全部除去,可以据此解答该题;
提出问题2.(1)反应前装置A中含有空气,而反应后生成的二氧化碳不能全部被吸收,可以据此分析并完成解答;
(2)为了防止反应前A中的空气中含有的二氧化碳干扰实验结论并将反应中生成的二氧化碳全部吸收,实验开始前应该先将气体鼓出,实验结束后应该将生成的二氧化碳气体鼓出并吸收可以据此结合题给的步骤完成解答.
解答 解:【查阅资料】:(1)稀盐酸可以和碳酸氢钠反应生成气体,所以实验现象Ⅰ为产生了气泡;碳酸钠和稀盐酸反应的化学方程式为:Na2CO3+2HCl=2NaCl+H2O+CO2↑;
(2)碳酸钠可以和氢氧化钙溶液反应生成碳酸钙沉淀和氢氧化钠,该反应的化学方程式为Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;
实验探究:碳酸钠可以和氯化钙溶液反应生成白色的碳酸钙沉淀和氯化钠,该反应的化学方程式为:Na2CO3+CaCl2═CaCO3↓+2NaCl;碳酸氢钠和盐酸反应生成二氧化碳气体,所以加入稀盐酸后可以观察到有气泡冒出;
实验反思:碳酸钠也可以和稀盐酸反应生成气体,为了防止碳酸钠干扰实验现象,所以应该加入过量的氯化钙将碳酸钠全部除去;
提出问题2.(1)①反应前装置A中含有空气,空气中含有二氧化碳,空气中的二氧化碳被吸收而使测量结果不准确;
②反应后生成的二氧化碳在装置A中没有逸出,而不能全部被吸收,也会使测量结果不准确;
(2)为了防止反应前A中的空气中含有的二氧化碳干扰实验结论并将反应中生成的二氧化碳全部吸收,实验开始前应该先将气体鼓出,实验结束后应该将生成的二氧化碳气体鼓出并吸收所以正确的实验步骤为:①③②④⑥⑤⑦.
故答案为:
查阅资料:
(1)Na2CO3+2HCl=2NaCl+H2O+CO2↑;
(2)有白色沉淀产生;
实验探究:
| 实验步骤 | 实验现象 | |
| ①取少量样品溶于水,加入过量的CaCl2溶液. | 有白色沉淀产生; | 该反应的方程式:Na2CO3+CaCl2═CaCO3↓+2NaCl. |
| ②将上述反应后的混合液过滤,取滤液 滴加稀盐酸. | 有气泡冒出; | 证明猜想②成立. |
点评 解答这类题目时,首先,赏析问题情景,找到实验探究的反应原理;再根据实验的反应原理,分析推断出该物质的组成成分,然后得出所要探究的物质中该成分的组成.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:初中化学 来源: 题型:填空题
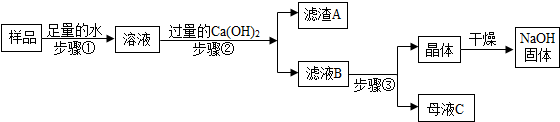
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
| 溶解度/g | Ca(OH)2 | 0.19 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 |
| NaOH | 31 | 91 | 111 | 129 | 313 | 336 | |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 氮气常用作保护气--氮气化学性质稳定 | |
| B. | 固体二氧化碳可用人工降雨--二氧化碳能与碱反应 | |
| C. | 氢氧化钙可用来改良酸性土壤--氢氧化钙溶液呈碱性 | |
| D. | 氧化钙可做食品干燥剂--氧化钙能与水反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
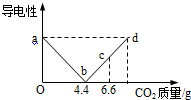 向盛有饱和澄清石灰水的烧杯中持续通入CO2出现了异常现象(先变浑浊后又变澄清.提示:过量的CO2会与CaCO3等反应生成可溶于水的Ca(HCO3)2),兴趣小组同学利用数字分析仪进行研究,测定记录得到溶液的导电性变化随二氧化碳的质量关系如下图所示.下列说法不正确的是( )
向盛有饱和澄清石灰水的烧杯中持续通入CO2出现了异常现象(先变浑浊后又变澄清.提示:过量的CO2会与CaCO3等反应生成可溶于水的Ca(HCO3)2),兴趣小组同学利用数字分析仪进行研究,测定记录得到溶液的导电性变化随二氧化碳的质量关系如下图所示.下列说法不正确的是( )| A. | ab段溶液逐渐变浑浊,bd段溶液逐渐变澄清 | |
| B. | b点溶液溶液碱性最强 | |
| C. | bd段反应为:CaCO3+CO2+H2O═Ca(HCO3)2 | |
| D. | c点溶液中含有2种溶质,沉淀质量为15g |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 磷在空气中燃烧产生大量白烟 | |
| B. | 在电解水实验中,正负两极产生的气体体积比约为2:1 | |
| C. | 打开盛有浓盐酸的试剂瓶,看到瓶口有大量白雾 | |
| D. | 取少量氢氧化钠暴露在空气中,氢氧化钠表面潮湿并逐渐溶解 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
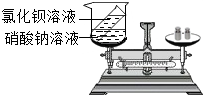 小章同学设计了如图所示的实验来验证质量守恒定律,在实验前左盘总质量为m,将试管中的溶液倒入烧杯后,左盘总质量为m,小章同学认为实验成功,你认为该实验设计合理吗?为什么?
小章同学设计了如图所示的实验来验证质量守恒定律,在实验前左盘总质量为m,将试管中的溶液倒入烧杯后,左盘总质量为m,小章同学认为实验成功,你认为该实验设计合理吗?为什么?查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
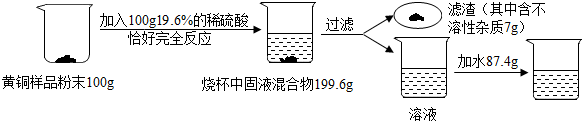
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
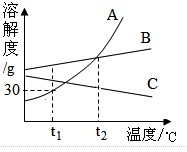
| A. | t2℃时,A,B两种物质的溶解度相等 | |
| B. | t1℃时,195克A物质的饱和溶液中含有45克A物质 | |
| C. | 将C物质的不饱和溶液变成饱和溶液可以采取升高温度的办法 | |
| D. | 将t1℃时,A,B,C三种物质的饱和溶液升温至t2℃时,所得溶液中溶质质量分数由大到小的顺序是A=B>C |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com