
| A. | NaCl | B. | HCl | C. | CaO | D. | CO2 |
 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:初中化学 来源: 题型:选择题
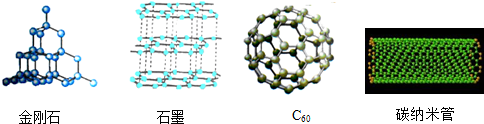
| A. | 金刚石属于金属单质 | B. | 石墨有优良导电性 | ||
| C. | 都是由碳原子直接构成的单质 | D. | 碳原子的排列方式相同 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 化石燃料作为重要的能源,对人类社会的发展百利无一害 | |
| B. | 可燃物在任何条件下燃烧都会发生爆炸 | |
| C. | 人类利用的能量都是通过化学反应获得的 | |
| D. | 选择燃料要综合考虑各种因素趋利避害 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
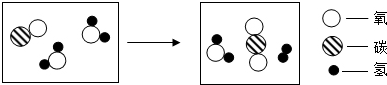
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
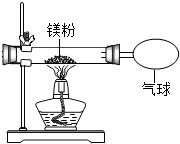 某兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验.
某兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验.| 实验操作 | 实验现象及结论 |
| 将镁条燃烧的产物放在一只试管中,加入少量的蒸馏水,然后将一湿润的红色石蕊试纸放在试管口,观察现象 | 看到红色的石蕊试纸变成蓝色,说明黄色固体为氮化镁 |
| 实验序号 | 实验1 | 实验2 | 实验3 | |
| 与镁条反应的溶液 | NH4Cl | NaCl | Na2SO4 | H2O |
| 实验现象 | 有大量气泡产生 | 有较多气泡产生 | 有少量气泡产生 | 气泡极少 |
| 加热后,实验现象 | 气泡明显增多可闻到氨味 | 气泡增多 | 气泡增多 | 气泡增多 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 固体烧碱要密封存放 | |
| B. | 浓硫酸露置于空气中会增重、变稀 | |
| C. | 浓盐酸露置于空气中会变轻、变稀 | |
| D. | 铜制品长期放在空气中会产生“铜锈”[又称“铜绿”,化学式为Cu2(OH)2CO3] |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
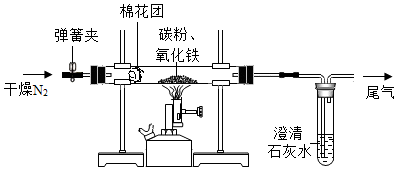
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com