
硫酸和盐酸既是实验室常用的试剂,也是重要的化工原料。
(1)它们的水溶液的pH都_________ 7(填“大于”、“小于”或“等于”)。分别将盛有浓盐酸、浓硫酸的试剂瓶敞口放置一段时间后,试剂质量增加的是___________(填化学式)。
(2)打开两瓶分别盛有浓硫酸和浓盐酸的试剂瓶,瓶口出现白雾的是_________。
(3)写出一个把硫酸转变为盐酸的化学方程式:______________________________。
小于 H2SO4 浓盐酸 H2SO4+BaCl2===2HCl+BaSO4↓ 【解析】本题盐酸与硫酸的物理性质和化学性质。 (1)酸的水溶液显酸性,pH值小于7;浓硫酸具有吸水性,能吸收空气中水蒸气,浓盐酸具有挥发性。分别将盛有浓盐酸、浓硫酸的试剂瓶敞口放置一段时间后,试剂质量增加的是浓硫酸,化学式是H2SO4; (2)浓盐酸易挥发出氯化氢气体,氯化氢气体极易溶于水,会与空气中的... 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:初中化学 来源:江苏省2018届九年级二模考试化学试卷 题型:实验题
请结合如图回答问题。
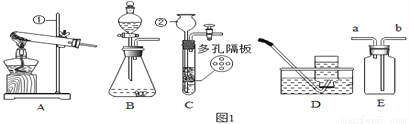
(1)仪器②的名称:______。
(2)用氯酸钾和二氧化锰制取氧气,可选用装置______(选填序号)和装置D组合,二氧化锰的作用是______,若用B和D组合制取氧气,其反应的化学方程式为______。
(3)实验室可用装置B或C制H2,C装置相对于B的优点有______,用E装置收集H2,气体应从______(选填“a”或“b”)端通入。若E中装满水,氢气从____(选填“a”或“b”)端通入。
(4)某些大理石中含少量硫化物,使制得的CO2中混有H2S等气体。欲获取纯净、干燥的CO2,设计实验如下:
查阅资料:I.H2S能与NaOH、CuSO4等物质反应。
Ⅱ.CO2中混有的HC1气体可用饱和NaHCO3溶液吸收。
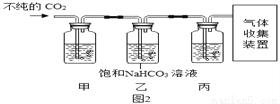
①装置甲中所盛试剂应选用______(填字母)。
a.浓硫酸 b.NaOH溶液 c.澄清石灰水 d.CuSO4溶液
②装置丙的作用是______。
长颈漏斗 A 催化作用 2H2O2 2H2O+O2↑ 即开即停 a a d 干燥二氧化碳 【解析】根据所学知识和题中信息知,(1)仪器②的名称:长颈漏斗。(2)用氯酸钾和二氧化锰制取氧气,可选用装置A和装置D组合,反应物是固体需加热制取气体,氧气不易溶于水,可以用排水法收集,二氧化锰的作用是催化作用,若用B和D组合制取氧气,反应物是液体和固体不需加热制取气体,其反应的化学方程式为2H2O2 ...查看答案和解析>>
科目:初中化学 来源:江苏省扬州市2018届九年级下学期第二次模拟考试化学试卷 题型:流程题
无水溴化钙可用作阻燃剂、制冷剂,具有易溶于水,易吸潮等性质。实验室用工业大理石(含有少量Al3+、Fe3+等杂质)制备溴化钙的主要流程如下:完成下列填空:

⑴上述使用的氢溴酸的质量分数为26%,若用47%的氢溴酸配置26%的氢溴酸,所需的玻璃仪器有玻璃棒、烧杯、_________ 和________ ;步骤I溶解中发生的化学反应方程式为___________。
⑵已知步骤Ⅲ的滤液中不含NH4+。步骤Ⅱ加入的试剂a是 _______,控制溶液的pH约为8.0,将Al3+、Fe3+分别转化成沉淀而除去,写出沉淀的化学式________、 __________。
⑶试剂b是_________ ,步骤Ⅳ的目的是 _______________________ 。
⑷步骤Ⅴ所含的操作依次是 _______________ 、____________ 、过滤。
⑸制得的溴化钙可以通过如下步骤测定其纯度:
①称取4.00g无水溴化钙样品;②溶解;③滴入过量Na2CO3溶液,充分反应后过滤;④洗涤、________;⑤称量得到1.88g碳酸钙。
a.请将上述步骤④补充完整,检验碳酸钙沉淀已经洗涤干净的方法是:取最后一次洗涤液,滴加__________溶液,若无白色沉淀产生,则已洗干净。
b.依据测定数据,请计算出样品中溴化钙的质量分数为________。(写出计算过程)。
c.若上述测定溴化钙纯度的实验操作规范,但测定结果偏低,其原因可能是 ________ 。
量筒 胶头滴管 CaCO3+2HBr=CaBr2+H2O+CO2↑ Ca(OH)2 Al(OH)3 Fe(OH)3 氢溴酸(或HBr) 除去过量的氢氧化钙 蒸发浓缩 冷却结晶 烘干 CaCl2(或BaCl2) 94% 溴化钙吸水 【解析】(1)配制溶液所需的玻璃仪器有玻璃棒、烧杯、量筒和胶头滴管;步骤I溶解中发生的反应是碳酸钙与氢溴酸反应溴化钙和二氧化碳和水,反应生成的化学反应方程式为CaC...查看答案和解析>>
科目:初中化学 来源:江苏省扬州市2018届九年级下学期第二次模拟考试化学试卷 题型:单选题
下列实验现象的描述错误的是
A. 干冰放置在空气中周围有白雾
B. 铜丝在空气中加热表面变黑
C. 硫酸铜溶液能与氢氧化钠溶液反应产生白色沉淀
D. 氨气遇到湿润的红色石蕊试纸,试纸变蓝
C 【解析】A、干冰是固态的二氧化碳,干冰易升华吸热,使空气中的水蒸气液化为小水滴,故有白雾出现,正确; B、铜在空气中加热,铜与空气中的氧气反应生成黑色的氧化铜,正确; C、硫酸铜溶液能与氢氧化钠溶液反应产生蓝色的氢氧化铜沉淀,错误; D、氨气遇到湿润的红色石蕊试纸,氨气溶于水中形成氨水,氨水显碱性,试纸变蓝,正确。故选C。查看答案和解析>>
科目:初中化学 来源:江苏省扬州市2018届九年级下学期第二次模拟考试化学试卷 题型:单选题
下列有关说法错误的是
A. 香烟的烟气中含有一氧化碳
B. 燃放鞭炮会加剧雾霾天气的形成
C. 白色污染的消除办法是将废弃的塑料就地焚烧
D. 二氧化碳、甲烷都是能产生温室效应的气体
C 【解析】A、香烟的烟气中含有一氧化碳,对人体有害,正确; B、雾霾是由固体小颗粒形成的,燃放鞭炮会形成固体小颗粒,故正确; C、废弃的塑料就地焚烧会造成环境污染,故错误; D、二氧化碳、甲烷都是能产生温室效应的气体,正确。故选C。查看答案和解析>>
科目:初中化学 来源:四川省广安市邻水县2018届九年级下学期模拟考试(三)化学试卷 题型:单选题
除去下列物质中的少量杂质,所选用的试剂及操作方法均正确的是( )
选项 | 物质(括号内为杂质) | 试剂 | 操作方法 |
A | HCl(CO2) | 适量NaOH溶液 | 洗气 |
B | NaCl(NaOH) | 过量稀盐酸 | 蒸发结晶 |
C | CO2(CO) | 足量O2 | 点燃 |
D | 稀盐酸(稀硫酸) | 适量硝酸钡溶液 | 过滤 |
A. A B. B C. C D. D
B 【解析】A.HCl和二氧化碳都会与氢氧化钠反应,在除去杂质的同时也会除去主要物质,故A错误;B.过量的盐酸和氢氧化钠会生成氯化钠,氯化氢具有挥发性,剩余的盐酸在蒸发结晶挥发出去,后就只剩氯化钠固体,故B正确;C.一氧化碳是少量的,和二氧化碳均匀的混合在一起的,不能被点燃,故C错误;D.硫酸和硝酸钡会生成硫酸钡沉淀和硝酸,生成的硝酸对于盐酸也是杂质,故D错误;故选B。查看答案和解析>>
科目:初中化学 来源:四川省广安市邻水县2018届九年级下学期模拟考试(三)化学试卷 题型:单选题
用“分子的观点”解释下列现象,不正确的是( )
A.湿衣晾干﹣﹣分子不停地运动
B.水结成冰﹣﹣分子发生变化
C.干冰升华﹣﹣分子间间隔变大
D.轮胎充气﹣﹣分子间有间隔
B 【解析】 试题分析:根据分子的基本特征:分子质量和体积都很小;分子之间有间隔;分子是在不断运动的;同种物质的分子性质相同,不同物质的分子性质不同,逐项进行分析判断即可. 【解析】 A、湿衣晾干是因为水分子在不停地运动,运动到空气中去了;故选项解释正确. B、水结成冰是因为水分子间的间隔发生了变化,而不是分子发生了变化;故选项解释错误. C、干冰升华是因为二氧化碳...查看答案和解析>>
科目:初中化学 来源:上海市金山区2018届九年级中考二模化学试卷 题型:单选题
对于尿素[化学式 CO(NH2)2]的描述正确的是( )
A. 含有2个氢分子
B. 摩尔质量是 60g
C. 尿素中N元素的质量分数最大
D. 尿素中N元素与氢元素的质量比为 7:2
C 【解析】A、尿素分子中不含有氢分子只含有氢原子,错误;B、尿素的摩尔质量是60g/mol,错误;C、尿素中碳、氧、氮、氢四种元素质量比为(12×1):(16×1):(14×2):(1×4)=3:4:7:1,所以其中氮元素的质量分数最大,正确;D、尿素中氮元素与氢元素的质量比为(14×2):(1×4)=7:1,错误。故选C。查看答案和解析>>
科目:初中化学 来源:山东省临沂市沂南县2018届九年级期中教学质量检测化学试卷 题型:填空题
如图为A、B两种固体物质的溶解度曲线。
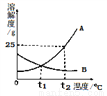
(1)t2℃时,100g水中溶解___gA物质恰好饱和,该饱和溶液中溶质的质量分数为_____。
(2)t2℃时,分别将恰好饱和的A、B两种物质的溶降温至t1℃,溶质的质量分数保持不变的是______。
25 20% B 【解析】在溶解度曲线图上,横坐标是温度,纵坐标是溶解度。溶解度是一定温度下,100g溶剂里达到饱和时,所溶解的溶质的质量。饱和溶液是在一定温度下、一定量的溶剂里不能再溶解某物质的溶液叫该物质的饱和溶液,反之为不饱和溶液。(1) ,t2℃时,100g水中溶解25gA物质恰好饱和,该饱和溶液中溶质的质量分数为25g÷(25g+100g)×100%=20%;(2)t2℃时,分别将...查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com