
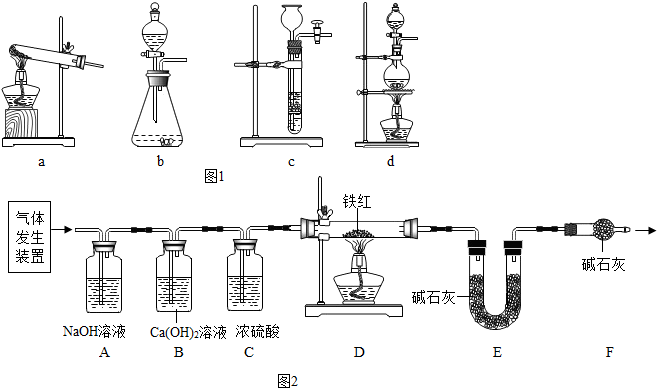
分析 草酸晶体(H2C2O4•3H2O)在浓硫酸作用下受热分解,因此选用d装置;实验前应先检查装置的气密性,二氧化碳一般用氢氧化钠溶液吸收,用澄清的石灰水检验,还可以检验二氧化碳是否除尽,二氧化碳可以用浓硫酸干燥;加热之前通入一氧化碳的目的是:将装置中的空气排出,防止发生爆炸;加热之后通入一氧化碳的目的是:驱赶装置中滞留的二氧化碳,使其全部被E装置中碱石灰全部吸收.一氧化碳和氧化铁在高温的条件下生成铁和二氧化碳,配平即可;如果全部是氧化铁,铁的最少量是10g×70%=7.0g,如果全部是氧化亚铁,铁的最大量是10g×77.8%=7.78g;E装置增重6.6g,那么二氧化碳是6.6g,氧元素的质量=6.6g×$\frac{32}{44}$×100%=4.8g,因为4.8g氧元素的质量一半来自于一氧化碳,一半来自于铁的氧化物,那么铁红中氧元素的质量是4.8g÷2=2.4g,则铁红中铁的质量分数=$\frac{10g-2.4g}{10g}$×100%=76.0%;本实验中如果缺少C装置,水蒸气会通过,E装置也具有吸水性,因此E装置会增重,氧元素的质量偏大,则测得样品中铁的质量分数会偏小;实验装置的一个明显缺陷:缺少尾气处理装置或检验水是否除尽;由赤铁矿石的质量、氧化铁的质量分数、生铁中铁的质量分数,根据赤铁矿炼铁的化学方程式可以列式计算出炼出生铁的质量.
解答 解:(1)草酸晶体(H2C2O4•3H2O)在浓硫酸作用下受热分解,因此选用d装置,故答案为:d;
(2)实验前应先检查装置的气密性,故答案为:检查装置的气密性;
(3)B装置还可以检验二氧化碳是否除尽,故答案为:验证二氧化碳已除尽;
(4)加热之前通入一氧化碳的目的是:将装置中的空气排出,防止发生爆炸;加热之后通入一氧化碳的目的是:驱赶装置中滞留的二氧化碳,使其全部被E装置中碱石灰全部吸收.故答案为:将装置中的空气排出,防止发生爆炸.(合理即可)
(5)一氧化碳和氧化铁在高温的条件下生成铁和二氧化碳,配平即可;故答案为:3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,(一氧化碳与FeO、Fe3O4也可以)
(6)如果全部是氧化铁,铁的最少量是10g×70%=7.0g,如果全部是氧化亚铁,铁的最大量是10g×77.8%=7.78g;E装置增重6.6g,那么二氧化碳是6.6g,氧元素的质量=6.6g×$\frac{32}{44}×100%$=4.8g,因为一个一氧化碳分子只能抢氧化铁中一个氧原子变成二氧化碳,因此氧元素的质量一半一半,4.8g氧元素的质量一半来自于一氧化碳,一半来自于铁的氧化物,那么铁红中氧元素的质量是4.8g÷2=2.4g,则铁红中铁的质量分数=$\frac{10g-2.4g}{10g}$×100%=76.0%;故答案为:①7.0<m<7.78;②76.0%
【实验评价】
本实验中如果缺少C装置,水蒸气会通过,E装置也具有吸水性,因此E装置会增重,氧元素的质量偏大,则测得样品中铁的质量分数会偏小;实验装置的一个明显缺陷:缺少尾气处理装置.故答案为:偏小;缺少尾气处理装置;
【拓展探究】设理论上可以炼出含铁98%的生铁的质量为x.
Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2
160 112
100t×80% 98%x
$\frac{160}{112}=\frac{100t×80%}{98%x}$
解得:x≈57.1t
答:可炼出含铁98%的生铁57.1t.
点评 本考点属于实验探究题,实验探究题是近几年中考的热点之一,它包括实验方法和过程的探究,实验结论和实验规律的探究等.本题通过实验现象和分析,得到了正确的结论,属于实验过程和结论的探究.同学们要具体分析,综合掌握.本题型主要出现在实验题中.


科目:初中化学 来源: 题型:选择题
| A. | Y>X>M>N | B. | Y>X>N>M | C. | N>M>X>Y | D. | X>Y>M>N |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 安多夫是一种嫩肉粉,其主要成分碳酸氢钠(NaHCO3)可破坏肉质纤维结构、促进肉类吸收水分,从而使肉质松软,达到鲜嫩爽滑的目的.小明发现将拌了安多夫粉的肉类放到锅中并加入食醋等调料烧煮时产生了大量气体,他对此颇感兴趣,决定对其进行探究.
安多夫是一种嫩肉粉,其主要成分碳酸氢钠(NaHCO3)可破坏肉质纤维结构、促进肉类吸收水分,从而使肉质松软,达到鲜嫩爽滑的目的.小明发现将拌了安多夫粉的肉类放到锅中并加入食醋等调料烧煮时产生了大量气体,他对此颇感兴趣,决定对其进行探究.| 实验步骤 | 实验现象 | 实验结论 | |
| 实验1 | 将醋酸滴入盛有碳酸氢钠的试管中,并把产生的气体通往澄清石灰水 | 产生气泡,澄清石灰水变浑浊. | 猜想①、②都正确 |
| 实验2 | 取碳酸氢钠样品少许加入试管中,加热使之充分反应,并把产生的气体通入澄清石灰水. | 试管口出现小水珠,澄清石灰水变浑浊. |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 物质 | 食盐水 | 肥皂水 | 食醋 | 酱油 |
| PH | 7 | 10 | 3 | 5 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 氯气只是一种氧化剂 | B. | 氯气只是一种还原剂 | ||
| C. | 氯气既是氧化剂也是还原剂 | D. | 氯气既不是氧化剂也不是还原剂 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
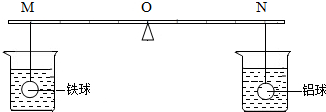 在杠杆的两端分别挂着质量和体积都相同的铁球和铝球,这时杠杆平衡.将两球分别浸没在质量相同、溶质的质量分数也相同的稀硫酸中(如图),直至两个烧杯中均没有气泡产生为止.两球的外形变化不大且无孔洞出现.下列推测中,正确的是( )
在杠杆的两端分别挂着质量和体积都相同的铁球和铝球,这时杠杆平衡.将两球分别浸没在质量相同、溶质的质量分数也相同的稀硫酸中(如图),直至两个烧杯中均没有气泡产生为止.两球的外形变化不大且无孔洞出现.下列推测中,正确的是( )| A. | 左端产生的氢气比右端的少 | |
| B. | 反应结束后要使杠杆平衡,支点应向N移动(液体体积变化忽略不计) | |
| C. | 拿掉烧杯后,杠杆仍然平衡(金属球上附着的液体忽略不计,下同) | |
| D. | 拿掉烧杯后,要想使杠杆平衡,支点应向M移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com