
| A. | 该物质的化学式可能为C2H6O | |
| B. | 该物质的分子中碳原子与氢原子的个数比为1:2 | |
| C. | 该物质只含有碳元素和氢元素 | |
| D. | 该物质中碳元素与氢元素的质量比为12:1 |
分析 在化学反应中,反应前后原子的种类没有改变,数目没有增减,原子的质量也没有改变,所以反应前后物质的质量总和相等.根据生成物CO2和H2O中C、H元素质量,可以确定可燃物中C、H元素比和原子个数比.
解答 解:根据质量守恒该物质中C、H元素的质量分别为4.4gCO2中C元素质量和2.7gH2O中H元素质量.4.4gCO2中C元素质量=4.4g×$\frac{12}{44}$×100%=1.2g; 2.7gH2O中H元素质量=2.7g×$\frac{2}{18}$×100%=0.3g;
A、可燃物中C、H元素质量比=1.2g:0.3g=4:1,生成物中含有C、H、O三种元素,所以可燃物中一定含C、H元素,可燃物中是否含O元素无法判断,C2H6O中C、H元素质量比为(12×2):(1×6)=4:1.说法正确;
B、利用原子个数比=$\frac{元素的质量}{相对原子质量}$之比,可求得可燃物中C、H原子个数比=$\frac{1.2g}{12}:\frac{0.3g}{1}$=1:3,说法不正确.
C、生成物中含有C、H、O三种元素,所以可燃物中一定含C、H元素,但是否含有O元素在此无法判断,说法不正确;
D、可燃物中C、H元素质量比=1.2g:0.3g=4:1,说法不正确;
故选A.
点评 本题主要考查有关化学式的计算,难度稍大.关键是找到确定该物质的元素组成、元素质量和原子个数比的方法.


科目:初中化学 来源: 题型:选择题
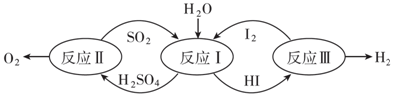
| A. | 反应Ⅰ方程式为:SO2+I2+2H2O=H2SO4+2HI | |
| B. | 反应Ⅱ中的第二步反应中,SO3分解生成S和O2 | |
| C. | 反应Ⅰ属于化合反应,反应Ⅱ、III属于分解反应 | |
| D. | 该生产工艺中最终被消耗的物质是H2O、S和I2 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 氯化钠用于配制生理盐水 | B. | 干冰用于人工降雨 | ||
| C. | 氢氧化铝用于治疗胃酸过多 | D. | 氢氧化钠用作食品干燥剂 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验操作 | 实验现象 | 实验结论 |
| 取一定量纯碱样品配成溶液后,滴加过量的CaCl2溶液. | 产生白色沉淀 | 反应的化学方程式: Na2CO3+CaCl2═CaCO3↓+2NaCl |
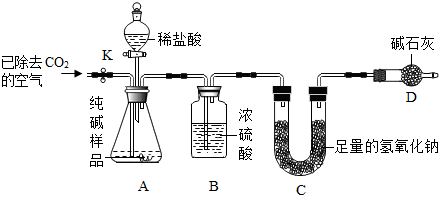
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
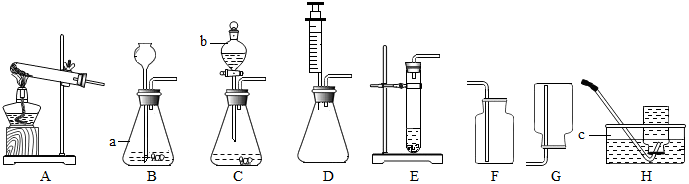
| 可能的原因 | 实验步骤 | 实验现象 | 实验结论 |
| 猜想的结论正确 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com