
| 氢氧根或酸根 溶解性 氢离子或金属离子 | OH- | CO32- |
| Na+ | 溶 | ① |
| Ca2+ | 微 | 不 |
| A. | ①处物质是Na2CO3 | B. | ①处物质可溶于水 | ||
| C. | ①处物质可用作洗涤剂 | D. | ①处物质属于碱 |
分析 根据表格提供的信息以及物质的性质进行分析解答即可.
A、①处物质是由钠离子和碳酸根离子构成的,进行分析判断.
B、根据碳酸钠属于钠盐,进行分析判断.
C、根据碳酸钠的用途进行分析判断.
D、①处物质是由钠离子和碳酸根离子构成的化合物,进行分析判断.
解答 解:A、①处物质是由钠离子和碳酸根离子构成的,该物质为Na2CO3,故选项说法正确.
B、碳酸钠属于钠盐,易溶于水,故选项说法正确.
C、①处物质是Na2CO3,可用作洗涤剂,故选项说法正确.
D、①处物质是由钠离子和碳酸根离子构成的化合物,属于盐,故选项说法错误.
故选:D.
点评 本题难度不大,掌握常见酸碱盐的溶解性表的应用、碳酸钠的用途等是正确解答本题的关键.


科目:初中化学 来源: 题型:实验探究题
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量稀氢氧化钠溶液于试管中,滴加1-2滴酚酞试液,变红后,往试管中滴加过氧化氢溶液,观察现象. | 溶液仍然为红色 | 不是过氧化氢使溶液褪色 |
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量原溶液于试管中,加入适量的水. | 溶液变成红色 | 氢氧化钠溶液浓度过大,导致溶液颜色褪去 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 不饱和溶液转化为饱和溶液,溶液中溶质的质量分数一定增大 | |
| B. | 将一定质量某物质的饱和溶液降温析出晶体后,所得溶液中溶质的质量分数一定减小 | |
| C. | 将5g某物质完全溶解与95g水中,所得溶液中溶质的质量分数一定是5% | |
| D. | 饱和溶液不一定是浓溶液,不饱和溶液一定是稀溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
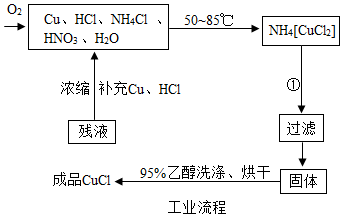

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量样品于试管中,加水溶解后再加入少量CaCl2溶液 | 产生白色沉淀 | 假设Ⅱ不成立,反应的化学方程式为Na2CO3+CaCl2═CaCO3↓+2NaCl. |
| 取少量样品于试管中,用导管连接后固定在铁架台上,导管的另一端插入澄清石灰水中.加热样品 | 有气体产生,澄清的石灰水变浑浊 | 假设Ⅰ不成立.则样品的成分是Na2CO3和NaHCO3. |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
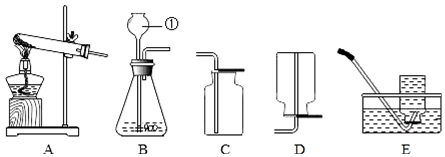
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 室温下的氯化钠饱和溶液不能再溶解氯化钾 | |
| B. | 取出部分上层溶液,可将接近饱和的氯化钠溶液变为饱和 | |
| C. | 可用硝酸银溶液鉴别氯化钠和氯化镁溶液 | |
| D. | 将100g质量分数为20%的氯化钠溶液稀释为10%,所用的仪器有:烧杯、量筒、玻璃棒和胶头滴管 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com