
| A. | 镁 | B. | 铝 | C. | 铁 | D. | 锌 |
分析 根据选项中各元素的相对原子质量和它们与稀硫酸反应的化学方程式,计算出1g这些金属分别与足量稀硫酸反应生成氢气的质量,再进行比较即可.
解答 解:A、Mg的相对原子质量为24,24g镁可反应生成2g氢气,即1g镁生成$\frac{1}{12}$g氢气.
B、Al的相对原子质量为27,27g铝可反应生成3g氢气,即1g铝生成$\frac{1}{9}$g氢气.
C、Fe的相对原子质量为56,56g铁可反应生成2g氢气,即1g铁生成$\frac{1}{28}$g氢气
D、Zn的相对原子质量为65,65g锌可反应生成2g氢气,即1g锌生成$\frac{1}{32.5}$g氢气.
因为$\frac{1}{9}$>$\frac{1}{12}$>$\frac{1}{28}$>$\frac{1}{32.5}$,所以铝放出的氢气最多.
故选B.
点评 本题主要考查考查学生运用所学化学知识综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
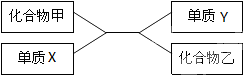 根据如图中化合物与单质相互转化的关系回答:
根据如图中化合物与单质相互转化的关系回答:查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 实验步驟 | 实验现象 | 实验结论或总结 | ||
| 各歩骤结论 | 总结 | |||
| 实验一 | 取10 mL 5%的过氧化氢溶液于一支试管中,用带火星的木条伸入试管,现察现象. | 试管中气泡很少,木条复燃 | 过氧化氢分解产生①氧气 | 氧化铜能作过氧化氢分解制氧气的催化剂 |
| 实验二 | 加热氧化铜粉末,用带火星的木条伸入试管,观察现象. | 木条不复燃 | 氧化铜受热 不产生氧气 | 氧化铜能作过氧化氢分解制氧气的催化剂 |
| 实验三 | 把一定质量的氧化铜粉末加入到装有②10 mL 5%的过氧化氢溶液的试管中,并用带火星的木条伸入试管,现察现象. | ③试管中气泡很多,木条复燃 | ④氧化铜加快了过氧化氢分解放出氧气的速率 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com