
| 次数 | 1 | 2 | 3 | 4 |
| 加入稀硫酸的质量/g | 35.0 | 35.0 | 35.0 | 35.0 |
| 剩余固体的质量/g | 6.821 | 5.6 | 4.4 | 4.2 |
分析 (1)铜不能与酸发生置换反应,因此,当金属混合物粉末与足量稀硫酸完全反应后,剩余固体质量即为铜的质量;
(2)由于35克硫酸参加反应金属每减少1.2克,由此可以求出第四次参加反应硫酸的质量,根据参加反应金属的质量与参加反应硫酸的质量计算金属的相对原子质量;根据相对原子质量判断金属元素;
(3)第三次加入硫酸充分反应后,由于金属有剩余因而所加稀硫酸完全反应,所得溶液为金属的硫酸盐溶液;根据反应的化学方程式则消耗金属的质量计算出反应生成硫酸盐的质量,所得质量与溶液的质量比即得溶液的质量分数;反应后所得溶液的质量由质量守恒定律进行求得.
解答 解:
(1)分析表格发现,前三次每加入35g硫酸,剩余固体的质量就减少1.2g,但是第四次加入35g硫酸,剩余固体的质量减少0.2g,说明另一种金属已经全部参加反应,剩余固体就是铜,所以铜的质量为4.2g.该混合物粉末中铜的质量分数=$\frac{4.2g}{8g}$×1005=52.5%;
(2)设该金属的相对分子质量为X,该金属为M.
以第一次加入35g硫酸为例,纯硫酸的质量是35g×14%=4.9g.
M+H2SO4═MSO4+H2↑
x 98
1.2g 4.9g
$\frac{x}{1.2g}=\frac{98}{4.9g}$
∴解得x=24,
根据相对原子质量表,则该金属为Mg.
(3)设MgSO4的质量为y,H2的质量为z.
第三次加入硫酸以后,总共加入硫酸的质量是35g×3=105g,则纯硫酸的质量是105g×14%═14.7gg.
Mg+H2SO4═MgSO4+H2↑
98 120 2
14.7g y z
$\frac{98}{14.7g}=\frac{120}{y}=\frac{2}{z}$
y=18g
z=0.3g
MgSO4溶液的质量分数为:$\frac{18g}{105g+3.6g-0.3g}$×100%≈16.6%
答:该混合物粉末中铜的质量分数是52.5%;该混合物粉末中另一金属为金属镁;第三次加入硫酸充分反应后,所得溶液中溶质的质量分数是16.6%.
点评 根据质量守恒定律,第三次加入稀硫酸充分反应后所得溶液的质量=参加反应金属的质量+三次所加稀硫酸的质量-反应放出氢气的质量;利用根据守恒定律化复杂的溶液计算为简便明了.


科目:初中化学 来源: 题型:解答题
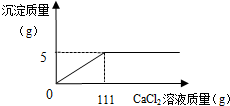 某碳酸钠和氯化钠的混合粉末21.2g,不断加入CaCl2溶液,产生沉淀的质量与所加入的CaCl2溶液的关系如图所示.
某碳酸钠和氯化钠的混合粉末21.2g,不断加入CaCl2溶液,产生沉淀的质量与所加入的CaCl2溶液的关系如图所示.查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前的质量(g) | 4.0 | 2.0 | 3.0 | 2.0 |
| 反应后的质量(g) | 1.2 | x | 2.4 | 5.4 |
| A. | X=2.0,乙可能是催化剂 | B. | 甲和丙是反应物 | ||
| C. | 丁一定是化合物 | D. | 参加反应的甲、丙质量比是1:2 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
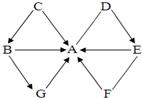 如图中A~G均是初中化学常见物质,它们之间的转化或相互反应关系均为初中常见反应,其中G属于单质,且被称为最理想能源,其余均为化合物,B和C物质类别相同,D、E溶于水所得溶液的pH大于7.图中“-”表示两端的物质能发生化学反应,“→”表示物质间存在转化关系,反应条件、部分反应物和生成物已略去.
如图中A~G均是初中化学常见物质,它们之间的转化或相互反应关系均为初中常见反应,其中G属于单质,且被称为最理想能源,其余均为化合物,B和C物质类别相同,D、E溶于水所得溶液的pH大于7.图中“-”表示两端的物质能发生化学反应,“→”表示物质间存在转化关系,反应条件、部分反应物和生成物已略去.查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 研制生产可降解塑料的主要目的是解决“白色污染”问题 | |
| B. | 区分硬水和软水可用肥皂水 | |
| C. | 煤燃烧过程中产生的二氧化硫是引起温室效应的主要物质 | |
| D. | 加入活性炭可除去水中的异味和色素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com