将14g不纯的KOH样品(杂质不溶于水)放入115.8g水中充分溶解后过滤(假设操作过程中KOH和水均无损失).在所得溶液中加入一定质量的稀HCl,恰好完全反应,得到溶质质量分数为7.45%的KCl溶液200g.
求:
(1)样品中KOH的质量分数.
(2)稀HCl中溶质的质量分数.
【答案】
分析:在本题中首先根据溶质的质量分数公式求氯化钾的质量,然后根据化学方程式中,已知氯化钾的质量求氢氧化钾和氯化氢的质量,再根据溶质的质量分数公式求溶液中溶质的质量分数.
解答:解:200g溶液中氯化钾的质量:200g×7.45%=14.9g
设样品中含氢氧化钾的质量为x;盐酸中氯化氢的质量为y.
KOH+HCl═KCl+H
2O
56 36.5 74.5
x y 14.9g

解得:x=11.2g;y=7.3g;
(1)样品中KOH的质量分数为:
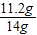
×100%=80%.
(2)稀HCl中溶质的质量分数为:

×100%=10%.
答:(1)样品中KOH的质量分数为80%.
(2)稀HCl中溶质的质量分数为10%.
点评:本考点考查了根据化学方程式的计算和质量分数公式的应用,是根据生成物的质量求反应物,是综合性比较强的计算题.


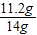 ×100%=80%.
×100%=80%. ×100%=10%.
×100%=10%.
