
分析 根据金属活动性顺序表的应用分析解答,在金属活动性顺序表中,位于前面的金属能把位于它后面的金属从其盐溶液中置换出来,因此只要排出它们的活动性顺序即可得解.
解答 解:化学反应里的反应顺序是由化学物质的活动性决定的,活动性越强的物质会越先反应. 金属与盐溶液发生置换反应:其中混合溶液与一种金属发生置换反应顺序是“先远”、“后近”.金属混合物与一种盐溶液发生置换反应顺序也是“先远”、“后近”.例如:硝酸银溶液和硝酸铜溶液中,加入铁,按金属活动性顺序,铁离银的位置远,则铁先与硝酸银反应,只有硝酸银反应完,再与硝酸铜反应.锌、铁加入硝酸银溶液中,按金属活动性顺序,锌离银远,则锌先与硝酸银反应,只有锌反应完,铁再与硝酸银反应.
故答为:硝酸银溶液和硝酸铜溶液中,加入铁,按金属活动性顺序,铁离银的位置远,则铁先与硝酸银反应,只有硝酸银反应完,再与硝酸铜反应;锌、铁加入硝酸银溶液中,按金属活动性顺序,锌离银远,则锌先与硝酸银反应,只有锌反应完,铁再与硝酸银反应.
点评 本题主要考查学生对金属活动性顺序表的灵活运用,位于前面的金属能把位于它后面的金属从其盐溶液中置换出来.


科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验序号 | 温度/℃ | H2O2溶液体积及浓度 | 催化剂 | O2体积/mL(均收集2min) |
| ① | 20 | 5mL、12% | 无 | V1 |
| ② | 60 | 5mL、12% | 无 | V2 |
| ③ | 20 | 5mL、4% | 无 | V3 |
| ④ | 20 | 5mL、12% | 0.5gCuCl2固体 | V4 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
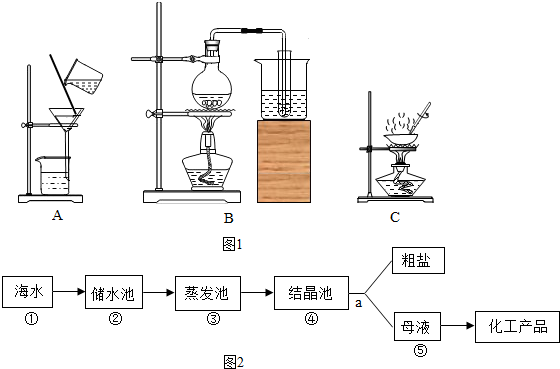
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | N(NO2)3中氮元素的化合价为+3 | |
| B. | N(NO2)3的相对分子质量为152 | |
| C. | N(NO2)3中氮元素和氧元素的质量比为7:12 | |
| D. | N(NO2)3中氮元素的质量分数为36.84% |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
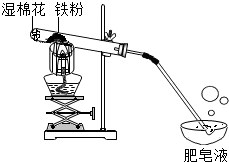 常温下没有氧气存在时,铁与水几乎不反应,但高温下,铁与水蒸气能反应生成一种常见铁的氧化物和一种气体.小明很好奇,设计如图所示实验,探究铁粉与水蒸气反应后的产物.
常温下没有氧气存在时,铁与水几乎不反应,但高温下,铁与水蒸气能反应生成一种常见铁的氧化物和一种气体.小明很好奇,设计如图所示实验,探究铁粉与水蒸气反应后的产物.| 常见铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
| 颜色、状态 | 黑色粉末 | 红棕色粉末 | 黑色晶体 |
| 能否被磁铁吸引 | 否 | 否 | 能 |
| 实验操作 | 实验现象 | 结论 |
| 猜想一成立 | ||
| 猜想二成立 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com