
| 实验步骤 | 实验现象 | 解释或结论 |
| ①取适量烧碱样品置于试管中,加水溶解,并用手触摸试管外壁. | 试管外壁发热 | 原因是氢氧化钠溶于水放热 |
| ②向①所得的溶液中逐滴加入过量稀硝酸 | 一开始无明显现象,一段时间后产生能使澄清石灰水变浑浊的气体. | 样品中含有的 杂质是碳酸钠. |
| ③向②所得的溶液中滴加几滴硝酸银溶液 | 产生白色沉淀 | 样品中还含有的杂 质是氯化钠 |
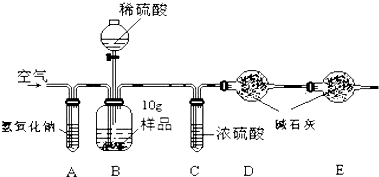
分析 根据物质的性质进行分析,氢氧化钠固体溶于水会放出大量的热,氢氧化钠能与二氧化碳反应生成碳酸钠,碳酸盐能与酸反应产生气体,氯化银是不溶于稀硝酸的白色沉淀;测定氢氧化钠中碳酸钠的含量需要测定生成二氧化碳的质量,据此解答即可.
解答 解:Ⅰ、
(2)①烧碱样品溶于水,试管外壁热,说明氢氧化钠溶于水会放出大量的热,故填:氢氧化钠溶于水放热;
②加入某种试剂,溶液中产生了气体,说明物质中含有碳酸钠,则加入的试剂是酸,根据③加入硝酸银产生白色沉淀,可以确定加入的酸是稀硝酸,故填:稀硝酸;碳酸钠;
③要证明氯化钠的存在,可以加入硝酸银溶液,观察到有白色沉淀生成,故填:氯化钠;
Ⅱ.定量探究
(1)空气中含有二氧化碳,通过氢氧化钠溶液能将空气中的二氧化碳除去,故填:除去空气中的二氧化碳气体;
(2)开始时由于装置中含有二氧化碳,所以要先通一段时间除去二氧化碳的空气,以把装置中含有的二氧化碳除去,防止对实验结果造成干扰,故填:将容器中的空气排干净,减小实验误差;
(3)碳酸钠能与稀硫酸反应生成硫酸钠、水和二氧化碳,滴加到不再产生气泡,是使碳酸钠全部参加反应,故填:Na2CO3+H2SO4═Na2SO4+H2O+CO2↑; 保证将样品中的碳酸钠反应完,使测量结果更准确;
(4)为防止空气中的二氧化碳进入装置D,故使用E装置吸收从右侧进入的空气中的二氧化碳;反应中产生的二氧化碳被D装置中的碱石灰吸收,故需要测定D装置的质量,故填:吸收从装置右侧进入的空气的CO2;D.
点评 本考点属于实验探究题,综合性比较强.根据题目提供的信息,结合实验探究的一般步骤和碱的性质等知识来解决,还要注意化学方程式的书写和配平,本考点主要出现在实验题中.


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 化学兴趣小组在老师指导下,对“蜡烛燃烧的产物”进行探究.
化学兴趣小组在老师指导下,对“蜡烛燃烧的产物”进行探究.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
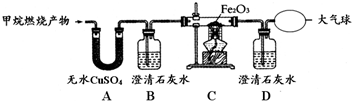
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
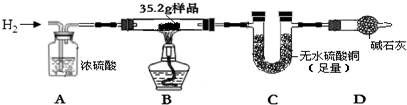
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

| 实验步骤 | 实验现象 | 实验结论及化学方程式 |
| 点燃酒精灯加热,随即打开弹簧夹,通入干燥的空气. 观察装置B、装置C中的现象 | 装置B中的现象是:黄色试纸变蓝 装置C中的现象是:澄清石灰水变浑浊 | 聚乙烯塑料在空气中燃烧,生成碳的氧化物中,既有CO2,也有CO. 装置C中反应的化学方程式为:Ca(OH)2+CO2═CaCO3↓+H2O |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验现象 | 实验结论 |
| 黑色固体红热并逐渐减少,最后消失 | 该黑色固体是木炭. 反应的化学方程式是C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 水蒸发为水蒸气,体积变大.温度升高,分子变大 | |
| B. | 3000L液化气在加压的情况下可装入20L的刚瓶中.-压强增大,分子间的间隔变小 | |
| C. | 香水、汽油要密封保存.-分子在不停的运动 | |
| D. | 湿衣服在阳光下比在阴凉处干得快.温度越高,分子运动的速度越快 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com