
氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应制备:Al2O3+N2+3C 2AlN+3CO,若要得到41Kg的氮化铝,则至少需要参加反应的氧化铝(Al2O3)的质量为多少千克?
2AlN+3CO,若要得到41Kg的氮化铝,则至少需要参加反应的氧化铝(Al2O3)的质量为多少千克?
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:初中化学 来源: 题型:计算题
“过碳酸钠”(化学式可表示为2Na2CO3?3H2O2)俗称固体双氧水,极易分解,它既有碳酸盐的性质,又有双氧水的不稳定性和氧化性,是很好的消毒剂和供氧剂,广泛应用于洗涤、印染和医药等领域.现将一定质量的过碳酸钠粉末溶于m克水中配成稀溶液,再向其中加入适量二氧化锰粉末,充分反应后生成4.8g气体.将反应后的混合物过滤,测得滤液的溶质质量分数为10.6%,求m.(不考虑损耗)
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
根据侯德榜制碱法原理,实验室制备纯碱(Na2CO3)的主要步骤是::将配制好的饱和NaCl溶液倒入烧杯中加热,控制温度在30-35℃,搅拌下分批加入研细的NH4HCO3固体,加料完毕后,继续保温30分钟,静置、过滤得NaHCO3晶体。用少量蒸馏水洗涤除去杂质,经过处理后,转入蒸发皿中,灼烧2小时,得Na2CO3固体。
四种盐在不同温度下的溶解度(g)表
 温度 温度 溶解度 盐 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | ① | —— | —— | —— |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | —— |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
|
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
NaOH潮解后极易与空气中的CO2反应生成Na2CO3而变质.为测定实验室一瓶放置已久的烧碱中NaOH含量,某同学取适量的烧碱样品,溶于一定量的水得到200g溶液;再加入200g稀硫酸(足量)充分搅拌到不再放出气泡为止,称量溶液为395.6g.
请计算:
(1)反应产生的CO2的质量为 g.
(2)若所取烧碱样品为50.0g,则样品中NaOH的质量分数是多少?
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
有一种由氯化钠和硝酸钠组成的固体混合物12.35g,加入27g水使其完全溶解,滴入硝酸银溶液75g,恰好完全反应,生成氯化银沉淀14.35g.计算:
(1)混合物中,氯化钠的质量。
(2)反应后滤液中溶质的质量分数。
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
碘元素对青少年智力发育影响很大,加碘盐通常在食盐中加碘酸钾(KIO3).如图所示:
超市销售的一种加碘盐标签上的部分文字说明.请回答下列问题:
(1)碘酸钾中钾、碘、氧三种元素质量比为 .
(2)每袋该食盐中碘元素的质量 mg.
(3)中国营养学会推荐:一个18岁的青年每天摄入碘元素的质量为0.15mg.假设碘的来源仅靠这种加碘食盐,该青年每天摄入这种食盐应为 g.
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
小明在老师的指导下测一瓶稀盐酸的溶质质量分数,具体步骤如下:
步骤一:配制溶质质量分数为1%的氮氧化钠溶液.
步骤二:向20 克待测稀盐酸中逐滴滴入上述氢氧化钠溶液,并使用pH计记录溶液的pH变化情况,绘制图象如图.
(1)在步骤一中需要用到的玻璃仪器有 (写出两种).
(2)已知发生反应的化学方程式为:NaOH 十HCl=NaCl+H2O,请结合图,计算该稀盐酸的溶质质量分数.(结果精确到0.01% )
(3)在往稀盐酸中逐渐滴入氢氧化钠溶液的过程中,当溶液的pH达到2时,溶液中的溶质有 .(用化学式表示)
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
氢气还原氧化铜生成红色固体,这些红色固体是什么物质?某科学兴趣小组查阅资料得知,反应温度不同,氢气还原氧化铜的产物可能是Cu或Cu2O,Cu和Cu2O均为不溶于水的红色固体,但氧化亚铜能与稀硫酸反应,化学方程式为:Cu2O+H2SO4═CuSO4+Cu+H2O为探究反应后的红色固体中含有什么物质?他们提出了以下假设:
假设一:红色固体只有Cu
假设二:红色固体只有Cu2O
假设三:红色固体中有Cu和Cu2O
请回答有关问题:
(1)取少量红色固体,加入足量的稀硫酸,若无明显现象,则假设 成立;若看到溶液变成蓝色,且仍有红色固体,则能否支持假设三? (选填“能”或“不能”)
(2)现将3克红色固体加入足量的稀硫酸中,反应后的溶液过滤,称得烘干后的滤渣质量为1.4克,则原红色固体中含有什么物质? .
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
我们知道,每次做完实验后,剩余废液不能直接倾倒入排污管,必须回收处理.某班同学实验后收集到含有碳酸钠和氢氧化钠的混合废液5.11Kg,一个兴趣小组用废弃的溶质质量分数为19.6%的硫酸来处理,并回收处理后的溶液.他们向废液中加入稀硫酸时,所得溶液pH与加入的稀硫酸质量的关系曲线如图所示.求: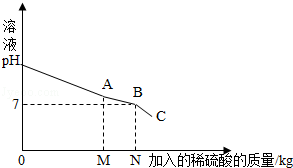
(1)通过如图可知,当反应进行至图中 点时(填“A”、“B”或“C”),废液恰好处理完(即碳酸钠和氢氧化钠混合废液刚好完全转化成硫酸钠溶液).
(2)当向混合液中加入稀硫酸至N点时,加入的稀硫酸质量为5Kg,此时溶液总质量为10Kg.求此时所得溶液中溶质的质量分数(写出计算过程,溶于水的气体忽略不计).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com