
| A.1∶2∶3 | B.3∶2∶1 |
| C.6∶3∶2 | D.4∶2∶1 |
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:初中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
 2CuO + H2O +
2CuO + H2O + ↑,“
↑,“  ”的化学式是 。
”的化学式是 。查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
 CaO + CO2 ↑ ,测得反应后固体的质量(m)与反应时间(t)的关系如下表:
CaO + CO2 ↑ ,测得反应后固体的质量(m)与反应时间(t)的关系如下表:| 反应时间t∕s | t0 | t1 | t2 | t3 | t4 | t5 | t6 |
| 反应后固体的质量m∕g | 100 | 92 | 84 | 78 | 72 | 67 | 67 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
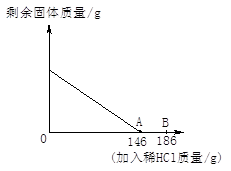
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
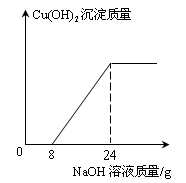
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com