
分析 将试管内的剩余固体冷却后溶于水,过滤、洗涤、干燥得到纯净固体3.25g,可以知道该固体为二氧化锰,由于反应至不再产生气体,说明氯酸钾以完全分解,那么所得溶液为氯化钾溶液,可以知道氯化钾的质量7.45g;可以据此结合化学方程式进行解答.在求算氯元素的质量分数时,可结合化合物中元素质量分数的计算方法求出氯酸钾中氯元素的质量,然后带入固体的总质量求算即可.
解答 解:(1)该题中发生的反应为氯酸钾的分解反应,该反应生成了氯化钾和氧气,其中二氧化锰充当的是催化剂,该反应的化学方程式为:2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑;
(2)设氯酸钾的质量为x,生成氧气的质量为y,则:
2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑
245 149 96
x 7.45g y
$\frac{245}{x}$=$\frac{149}{7.45g}$=$\frac{96}{y}$
解得:x=12.25g;y=4.8g
(3)氯酸钾中氯元素的质量为:12.25g×$\frac{35.5}{39+35.5+16×3}$×100%=3.55g
所以原混合物中氯元素的质量分数为:$\frac{3.55g}{12.25g+3.25g}$×100%=22.9%;
答:(2)氯酸钾的质量为12.25g,反应放出气体的质量为4.8g;
(3)原混合物中氯元素的质量分数为22.9%.
故答案为:
(1)2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑;
(2)氯酸钾的质量为12.25g,反应放出气体的质量为4.8g;
(3)22.9%.
点评 解答好这类题目,首先,要理解和熟记根据化学反应方程式的计算步骤和格式,以及与之相关的知识等.然后,根据所给的问题情景或图表信息等,结合所学的相关知识和技能,细致地分析题意(或图表信息)等各种信息资源,并细心地探究、推理后,按照题目要求进行认真地选择或解答即可.


科目:初中化学 来源: 题型:选择题
| A. | 用氯气和消石灰制漂白粉 | B. | 用氢气和氮气合成氨 | ||
| C. | 用铁矿石炼铁 | D. | 用石灰石生产生石灰 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
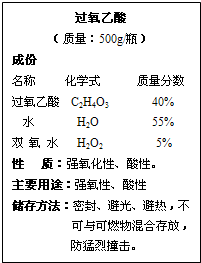 人们常利用过氧乙酸对环境进行消毒,现有某种市售的过氧乙酸(化学式为C2H4O3).其标签上的部分文字说明如右图.请回答下列问题:
人们常利用过氧乙酸对环境进行消毒,现有某种市售的过氧乙酸(化学式为C2H4O3).其标签上的部分文字说明如右图.请回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 小于10% | B. | 大于10% | C. | 不变 | D. | 无法判断 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
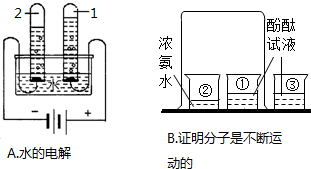
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

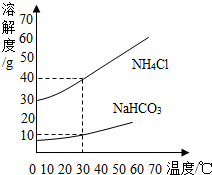
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com