



科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
 化学课后,化学兴趣小组的同学在整理实验桌时,发现有一瓶氢氧化钠溶液没有塞橡皮塞,征得老师同意后,开展了以下探究:
化学课后,化学兴趣小组的同学在整理实验桌时,发现有一瓶氢氧化钠溶液没有塞橡皮塞,征得老师同意后,开展了以下探究:| 实验操作 | 实验现象 | 实验结论 |
| 取少量该溶液于试管中,向溶液中滴加稀盐酸,并不断振荡. | 氢氧化钠溶液一定变质了. |
| 实验步骤 | 实验现象 | 实验结论 |
| (1)取少量该溶液于试管中,向溶液中滴加过量的氯化钡溶液,并不断振荡. | 有 | 说明原溶液中一定有碳酸钠. |
| (2)取步骤(1)试管中的少量上层清液,滴加酚酞溶液. | 溶液变红色. | 说明原溶液中一定有 |
查看答案和解析>>
科目:初中化学 来源: 题型:
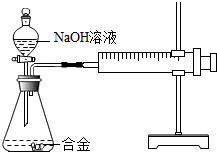 合金在生活中应用十分广泛.已知某合金粉末除含铝外,还含有铁、铜中的一种或两种.小明利用如图装置对合金粉末中铁、铜的存在进行探究时,误把氢氧化钠溶液当成稀硫酸加入到锥形瓶中,他惊奇的发现有无色气体放出,注射器活塞向右移动.
合金在生活中应用十分广泛.已知某合金粉末除含铝外,还含有铁、铜中的一种或两种.小明利用如图装置对合金粉末中铁、铜的存在进行探究时,误把氢氧化钠溶液当成稀硫酸加入到锥形瓶中,他惊奇的发现有无色气体放出,注射器活塞向右移动.| 实验步骤 | 实验现象 | 实验结论 |
| ①取一定量的合金粉末,加过量的 | 粉末部分溶解,并有无色气体放出 | 合金中一定含有 |
| ②取步骤①所得滤渣,加过量的 | 滤渣部分溶解,并有无色气体放出,溶液呈浅绿色 | 合金中一定含有 |
| 所加氢氧化钠溶液的次数 | 第一次 | 第二次 | 第三次 |
| 剩余固体的质量/g | 21.2 | 10.4 | 8.0 |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
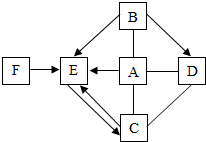 下列物质为初中化学常见物质,请根据叙述回答问题:
下列物质为初中化学常见物质,请根据叙述回答问题:查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
 在“宏观、微观、符号”之间建立联系,是化学学科特有的思维方式.
在“宏观、微观、符号”之间建立联系,是化学学科特有的思维方式. 表示碳原子;
表示碳原子; 表示氧原子;
表示氧原子; 表示氢原子)
表示氢原子)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com