
分析 根据题意,NaOH与稀硫酸反应生成硫酸钠和水,由200g溶质质量分数为4.9%的H2SO4溶液计算出参加反应的硫酸的质量,进而根据反应的化学方程式可以计算出参加反应的氢氧化钠、生成的硫酸钠的质量.
解答 解:200g溶质质量分数为4.9%的H2SO4溶液中溶质的质量为200g×4.9%=9.8g.
设混合物中NaOH的质量为x,生成硫酸钠的质量为y,
2NaOH+H2SO4═Na2SO4+2H20
80 98 142
x 9.8g y
(1)$\frac{80}{x}=\frac{98}{9.8g}=\frac{142}{y}$
x=8g
(2)y=14.2g
最后所得溶液中溶质为硫酸钠,其质量为:14.2g+(10g-8g)=16.2g.
最后所得溶液中溶质的质量分数为$\frac{16.2g}{200g+10g}$×100%=7.7%;
答:(1)10g混合物中NaOH的质量为8g;
(2)最后所得溶液中溶质的质量分数为7.7%,
点评 本题难度不大,掌握根据化学方程式的计算即可正确解答本题,根据溶质质量=溶液质量×溶质的质量分数计算出稀硫酸中溶质的质量是正确解答本题的关键.


科目:初中化学 来源: 题型:填空题
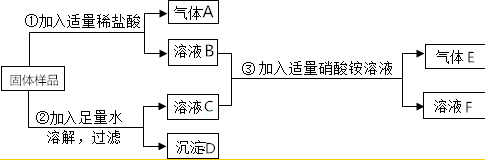
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
 溶解度曲线是物质溶解性的直观体现.如图是a、b、c三种物质的溶解度曲线,下列说法正确的是( )
溶解度曲线是物质溶解性的直观体现.如图是a、b、c三种物质的溶解度曲线,下列说法正确的是( )| A. | b物质可能是熟石灰 | |
| B. | a物质的溶解度大于b物质 | |
| C. | 使c物质结晶析出可以采用降温的方法 | |
| D. | t2时a、b两种物质饱和溶液的溶质质量分数相等 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ①②④ | C. | ②④⑤ | D. | ①③⑤ |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 硫在空气中燃烧,产生蓝紫色火焰 | |
| B. | 将二氧化碳通入水中,无明显现象 | |
| C. | 红亮的铜丝在酒精灯火焰上灼烧,铜丝表面变黑 | |
| D. | 一氧化碳通过灼热的氧化铁,红色固体变黑 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
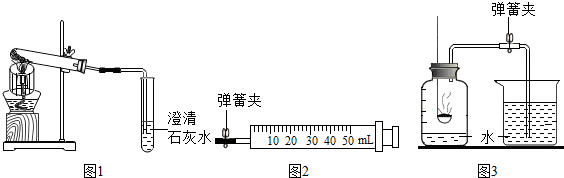
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com