

| 现象 | 分析 |
| 1 | |
| 2 |
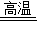 2Cu+CO2↑,所以现象为:试管内黑色粉末逐渐变为红色.是因为氧化铜失去氧而变成单质铜,单质铜的颜色为红色.
2Cu+CO2↑,所以现象为:试管内黑色粉末逐渐变为红色.是因为氧化铜失去氧而变成单质铜,单质铜的颜色为红色. 2Cu+CO2↑,
2Cu+CO2↑,| 现 象 | 分 析 |
| 1、澄清石灰水由澄清逐渐变浑浊.(或澄清石灰水由澄清逐渐变浑浊,又逐渐变澄清). | 木炭得到了氧化铜中的氧,生成了二氧化碳,二氧化碳使澄清石灰水逐渐变浑浊. |
| 2、试管中(有一部分)黑色粉末逐渐变红色. | 氧化铜失去氧而变成单质铜,单质铜的颜色为红色. |
 2Cu+CO2↑
2Cu+CO2↑

 走进文言文系列答案
走进文言文系列答案科目:初中化学 来源: 题型:
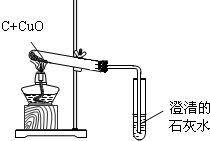
| 现象 | 分析 |
| 1 | |
| 2 |
查看答案和解析>>
科目:初中化学 来源:广东省期末题 题型:实验题
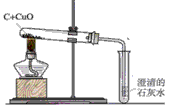

查看答案和解析>>
科目:初中化学 来源:不详 题型:问答题
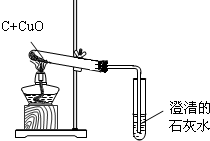
| 现象 | 分析 |
| 1 | |
| 2 |
查看答案和解析>>
科目:初中化学 来源:2007-2008学年广东省广州市番禺区九年级(上)期末化学试卷(解析版) 题型:解答题

| 现象 | 分析 |
| 1 | |
| 2 |
查看答案和解析>>
科目:初中化学 来源:2009-2010学年广东省广州市天河区九年级(上)期末化学试卷(解析版) 题型:解答题

| 现象 | 分析 |
| 1 | |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com