
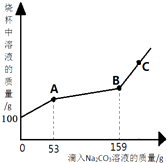
 在一烧杯中盛有100gBaCl2和HCl的混合溶液,向其中逐渐滴加溶质质量分数为10%的Na2CO3溶液,混合溶液的质量与所滴入Na2CO3溶液的质量关系曲线如图所示:请根据题意回答问题:
在一烧杯中盛有100gBaCl2和HCl的混合溶液,向其中逐渐滴加溶质质量分数为10%的Na2CO3溶液,混合溶液的质量与所滴入Na2CO3溶液的质量关系曲线如图所示:请根据题意回答问题:分析 (1)根据向盛有BaCl2和HCl的混合溶液中滴加Na2CO3溶液时,碳酸钠先与盐酸反应产生二氧化碳,当盐酸反应完后,再与氯化钡反应产生碳酸钡沉淀进行分析;
(2)开始时是生成气体的,由于加入的是碳酸钠溶液,而生成的是二氧化碳气体,两者的质量明显是增加多,减少的少,所以曲线明显上扬.当不再生成二氧化碳时,就生成碳酸钡,由于碳酸钡的质量要多于碳酸钠的,所以导致溶液的质量增加减缓.从图中曲线可看出,当滴入碳酸钠53g时,盐酸完全反应,据此可根据滴入碳酸钠质量计算放出气体质量;
根据化学方程式中参加反应的碳酸钠质量计算生成的碳酸钡沉淀质量;
(3)根据碳酸钠和氯化钡生成碳酸钡沉淀和氯化钠,碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,当滴入Na2CO3溶液至图中C点时,碳酸钠是过量的进行分析;
(4)从图中曲线可看出,开始滴入106克的碳酸钠与盐酸反应,53克~159克之间滴入碳酸钠与氯化钡反应;即与氯化钡反应的碳酸钠质量是159克-53克;
由化学方程式知,碳酸钠和盐酸、氯化钡反应后溶液中溶质均为氯化钠,可根据化学方程式中参加反应的碳酸钠质量计算生成的氯化钠质量和碳酸钡沉淀质量,再根据质量守恒定律,参加反应的物质总质量等于生成的物质总质量,最后所得不饱和溶液的质量等于l00gBaCl2和HCl的混合溶液,加上滴入的159gNa2CO3溶液,减去生成的气体和沉淀的质量,即可计算所得不饱和溶液中溶质质量分数.
解答 解:(1)碳酸钠和盐酸反应产生二氧化碳,有气体放出,与氯化钡反应产生碳酸钡,即有白色沉淀产生;
(2)设实验过程中放出的气体总质量为x,根据Na2CO3+2HCl=2NaCl+CO2↑+H2O,则
Na2CO3 ~CO2
106 44
53g×10% x
$\frac{106}{53g×10%}$=$\frac{44}{x}$
x=2.2g
设实验过程中产生碳酸钡质量为z,后期的碳酸钠中碳酸根转化为碳酸钡沉淀,所以对应的碳酸钠是53g溶液之后的部分为159g-53g=106g.
Na2CO3 ~BaCO3
106 197
106g×10% z
$\frac{106}{106g×10%}$=$\frac{197}{z}$
z=19.7g
(3)碳酸钠和氯化钡生成碳酸钡沉淀和氯化钠,碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,当滴入Na2CO3溶液至图中C点时,碳酸钠是过量的,所以烧杯中溶液里含有的溶质是:Na2CO3、NaCl;
(4)设实验过程中产生氯化钠质量为y,则整个过程的,不考虑是碳酸钠与盐酸还是和氯化钡反应,最终对应的钠都在氯化钠中.
Na2CO3 ~2NaCl
106 117
159g×10% y
$\frac{106}{159g×10%}$=$\frac{117}{y}$
y=17.55g
所得NaCl溶液的质量分数为:$\frac{17.55g}{100g+159g-19.7g-2.2g}$×100%=7.4%
故答案为:
(1)产生白色沉;
(2)2.2克,19.7克;
(3)Na2CO3、NaCl;
(4)7.4%.
点评 本题考查根据图象的有关化学方程式的计算,重在考查学生的识图,碳酸钠与两种物质都能发生反应,而首先是与盐酸反应,其次与氯化钡反应,此题较难,学生容易出错,平时要多注意训练.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:选择题
| A. | 接电源正极的试管内放出一种可燃性气体 | |
| B. | 与正极相连试管内产生的气体体积是与负极相连的试管内气体体积的2倍 | |
| C. | 与负极相连试管内产生的气体体积是与正极相连的试管内气体体积的2倍 | |
| D. | 与负极相连试管内产生的气体能使带火星的木条复燃 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 实验目的 | 主要操作 |
| A | 除去食盐中的泥沙 | 加足量水溶解、过滤、蒸发 |
| B | 区别蒸馏水与稀盐酸 | 分别取样,滴加无色酚酞试液 |
| C | 区别氢氧化钠和硝酸铵 | 分别取样,加适量水溶解后测温度变化 |
| D | 探究蜡烛中是否含有氢元素 | 将蜡烛点燃,在火焰上方罩干冷烧杯 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
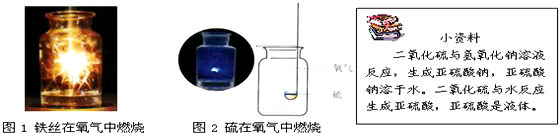
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com