
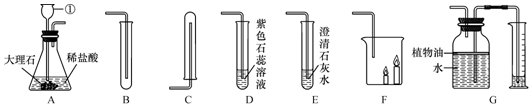
分析 (1)根据反应的原理以及分液漏斗的特点分析.
(2)根据二氧化碳的密度比空气大解答;
(3)根据二氧化碳的性质以及酸的性质来分析;
(4)根据二氧化碳能使澄清的石灰水变浑浊来分析;
(5)根据二氧化碳灭阶梯上蜡烛的实验现象,可以判断二氧化碳的物理性质和化学性质,并且可以判断二氧化碳的用途.
(6)用碳的燃烧来制取CO2时,反应物中有气体参加,很难收集到纯净的CO2气体,或燃烧的条件下,很难将其控制在一个密闭的环境中进行,因而无法收集.
解答 解:(1)大理石的主要成分是碳酸钙,与稀盐酸反应生成氯化钙、水和二氧化碳,反应的化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑;将长颈漏斗换成了分液漏斗,分液漏斗可以定量控制液体的用量,其优点是可以控制反应的速率.若A后接注射器检查该装置的气密性,当加水形成液封后,缓慢拉动活塞,看到长颈漏斗下端管口产生气泡;
(2)二氧化碳的密度比空气大,所以收集少量的二氧化碳可用B装置;验满的方法是:将燃着的木条置于试管口,若木条熄灭,证明已集满;
(3)二氧化碳与水反应生成碳酸,碳酸是一种酸,能使紫色的石蕊试液变红色,该反应的化学方程式为:CO2+H2O═H2CO3;
(4)二氧化碳与澄清的石灰水反应生成碳酸钙白色沉淀和水,该反应的化学方程式为:CO2+Ca(OH)2═CaCO3↓+H2O;
(5)二氧化碳的密度比空气大,不需要通过化学变化表现出来,属于二氧化碳的物理性质.二氧化碳不能燃烧,不支持燃烧,需要通过化学变化表现出来,属于二氧化碳的化学性质.若A与F连接,则F中出现的现象是矮的蜡烛先熄灭,高的蜡烛后熄灭;因为二氧化碳的密度比空气大,不能燃烧,不支持燃烧,所以二氧化碳可以用来灭火.
(6)G可用来测量生成CO2的体积,在水面上放一层植物油的目的是防止CO2溶于水且与水反应;植物油上方原有的空气对实验的结果没有明显影响.
故答案为:(1)CaCO3+2HCl═CaCl2+H2O+CO2↑;可控制反应速率;长颈漏斗下端管口产生气泡;(2)B;将燃着的木条置于试管口,若木条熄灭,证明已集满;(3)紫色石蕊溶液变成红色;CO2+H2O═H2CO3;(4)CO2+Ca(OH)2═CaCO3↓+H2O;(5)矮的蜡烛先熄灭,高的蜡烛后熄灭;不能燃烧;不能支持燃烧;灭火;(6)防止二氧化碳溶于水且与水反应;没有.
点评 本考点主要考查了气体的制取装置和收集装置的选择,同时也考查了化学方程式的书写和注意事项等,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 蒸发5克水有晶体析出 | B. | 把温度降到0℃有晶体析出 | ||
| C. | 加入极少量的硝酸钾不溶 | D. | 以上三种方法都可以 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ②①⑥③⑦④⑤ | B. | ②①③⑥④⑦⑤ | C. | ②⑥③①④⑦⑤ | D. | ①⑥②③④⑤⑦ |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com