
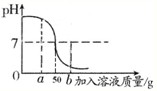
 向盛有45g蒸馏水的烧杯中加入含氯化钠的氢氧化钠的固体混合物5g,使之全部溶解后,向烧杯中滴加溶质质量分数为7.3%的稀盐酸,它们反应中溶液的pH与加入稀盐酸溶液的质量关系如图所示.请回答和计算下列问题:
向盛有45g蒸馏水的烧杯中加入含氯化钠的氢氧化钠的固体混合物5g,使之全部溶解后,向烧杯中滴加溶质质量分数为7.3%的稀盐酸,它们反应中溶液的pH与加入稀盐酸溶液的质量关系如图所示.请回答和计算下列问题: =
=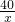 =
=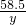
 ×100%=53.8%;
×100%=53.8%; ×100%=6.85%.
×100%=6.85%.

 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:阅读理解
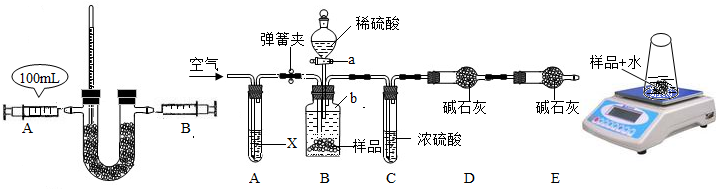
| 时间/s | 60 | 120 | 180 | 240 | 300 |
| 天平示数/g | 83.82 | 82.43 | 82.15 | 81.80 | 81.80 |
查看答案和解析>>
科目:初中化学 来源: 题型:
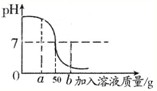 向盛有45g蒸馏水的烧杯中加入含氯化钠的氢氧化钠的固体混合物5g,使之全部溶解后,向烧杯中滴加溶质质量分数为7.3%的稀盐酸,它们反应中溶液的pH与加入稀盐酸溶液的质量关系如图所示.请回答和计算下列问题:
向盛有45g蒸馏水的烧杯中加入含氯化钠的氢氧化钠的固体混合物5g,使之全部溶解后,向烧杯中滴加溶质质量分数为7.3%的稀盐酸,它们反应中溶液的pH与加入稀盐酸溶液的质量关系如图所示.请回答和计算下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:
 (2013?房山区一模)水和溶液在生命活动和生产、生活中起着十分重要的作用.
(2013?房山区一模)水和溶液在生命活动和生产、生活中起着十分重要的作用.| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
| 溶解度 /g |
NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
| NH4Cl | 29.4 | 37.2 | 45.8 | 55.2 | 65.6 | 77.3 | |
查看答案和解析>>
科目:初中化学 来源:2012年中考化学模拟试卷(4)(解析版) 题型:解答题
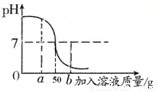
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com