
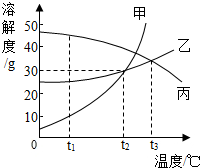
 甲、乙、丙三种固体物质的溶解度曲线如图所示,回答下列问题.
甲、乙、丙三种固体物质的溶解度曲线如图所示,回答下列问题.分析 (1)据溶解度曲线可比较同一温度下不同物质的溶解度大小;
(2)溶解度曲线的交点表示该温度下两物质的溶解度相等;
(3)据该温度下甲物质的溶解度分析解答;
(4)饱和溶液中溶质的质量分数=$\frac{溶解度}{溶解度+100g}$×100%,并结合物质的溶解度随温度变化分析解答;
(5)据不同温度下物质的饱和溶液,不饱和溶液变为饱和溶液的方法分析解答.
解答 解:(1)t1℃时,甲、乙、丙三种物质溶解度由大到小的顺序是丙>乙>甲;
(2)t2℃时,甲和乙的溶解度曲线交于一点,二者的溶解度相等;
(3)t2℃时,甲物质的溶解度是30g,即100g水中最多溶解30g的甲,所以饱和溶液中溶质与溶剂的质量比是30g:100g=3:10;
(4)饱和溶液中溶质的质量分数=$\frac{溶解度}{溶解度+100g}$×100%,由此可知:溶解度大则溶质的质量分数大;t3℃时,将乙和丙三种物质的饱和溶液同时降温到t1℃时,乙溶解度减小析出晶体,溶质质量减少,溶质的质量分数减小,丙溶解度增大,溶质、溶剂质量不变,溶质质量分数与降温前相等,而t1℃时乙的溶解度小于t2℃时丙的溶解度,故所得溶液中溶质的质量分数大小关系是乙<丙;
(5)丙的溶解度随温度降低而减小,所以欲使t1℃时丙的不饱和溶液变成饱和溶液,所采取的措施除了蒸发溶剂和加入溶质,还可以采取升温的方法;
故答案为:(1)丙>乙>甲;(2)相等;(3)3:10;(4)<;(5)升高温度.
点评 掌握溶解度曲线的意义、溶解度概念、不饱和溶液和饱和溶液的相互转化方法等知识才能正确解答相关问题.


科目:初中化学 来源: 题型:选择题
| A. | CO〔CO2〕-通过灼热的氧化铜 | B. | NaOH〔Ca(OH)2〕-加入氯化钙溶液 | ||
| C. | CaCO3固体〔CaO固体〕-高温煅烧 | D. | Cu粉〔Fe屑〕-磁铁分离 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 都能与指示剂作用 | B. | 都具有氢氧根原子团 | ||
| C. | 都含有金属元素 | D. | 都含有氢元素和氧元素 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com