
【题目】如图是常见物质之间的相互反应关系,其中甲、乙、丙、丁都是固体,且甲、乙是黑色固体,丁为红色单质:A和B常温时呈液态,且组成元素相间:E、G常温时呈气态,且组成元素相同。请你推断:
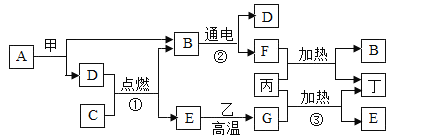
(1)物质B的化学式为_______,乙的化学式为_________。
(2)写出一个反应①的化学反应方程式为____________。
(3)反应②的基本反应类型为______________。
(4)反应③化学反应方程式为_______________。
【答案】H2O C 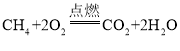 或
或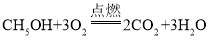 分解反应
分解反应 ![]()
【解析】
A和B常温时呈液态,且组成元素相间,而且A在甲的条件下可生成B和D,甲为黑色固体,B在通电的情况下可生成D和F,可推出A为过氧化氢,B为水,D为氧气,F为氢气,甲为二氧化锰,E、G常温时呈气态,且组成元素相同,E可与乙在高温下生成G,则E为二氧化碳,G为一氧化碳,乙为碳,丙与一氧化碳可在加热的情况下生成丁和二氧化碳,丁为红色固体,则丁为铜,丙为氧化铜。
(1)物质B为水,化学式为H2O,物质乙为碳,化学式为:C;
(2)C与氧气在点燃的条件下可生成二氧化碳和水,则C可以是甲烷或乙醇,其化学反应方程式是: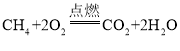 、
、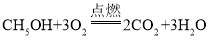 ;
;
(3)反应②为水在通电的情况下生成氧气和氢气,其化学反应方程式为: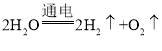 ,该反应符合“一变多”的特点,属于分解反应;
,该反应符合“一变多”的特点,属于分解反应;
(4)反应③为氧化铜和一氧化碳在加热的条件下生成铜和二氧化碳,其化学反应方程式为:![]() 。
。


科目:初中化学 来源: 题型:
【题目】多彩的“碳”,多姿的生活,让我们一起走进“碳”的世界。
(1)碳海绵是已知最轻的固体材料,由碳元素组成,具有多孔结构,弹性好,可重复处理海上石油泄漏,碳海绵具有很强的_____性。
(2)3g碳在空气中不充分燃烧,可生成无色气体的质量为_____g。
(3)液态二氧化碳灭火器可用于扑救档案资料室发生的火灾,液态二氧化碳气化后不会污染档案资料,可覆盖在燃烧物表面,隔绝_____,气化时吸热,可降低温度至着火点以下。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】每到夏天汛期,长江的水就显得特别浑浊,学校化学兴趣小组采集了一些江水样品,在老师指导下,进行了如下图所示的一些有关于水的实验:
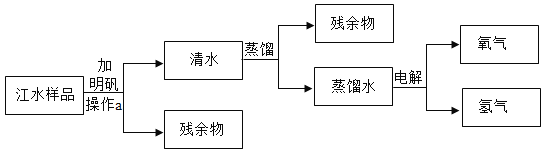
(1)操作a的名称是_____,需要的玻璃仪器有_____;
(2)在进行蒸馏实验时,老师让同学们在蒸馏烧瓶里加几片沸石,目的是_____;蒸馏实验中水发生了_____(填“物理”或“化学”)变化。
(3)在实验室中进行电解水实验的目的是为了探究_____,可以得出的结论是_____,这个实验的文字表达式是_____。
(4)可以用_____来检验江水是硬水还是软水,生活中人们通常采用_____的方法来降低水的硬度。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我国科学家研究出碳化钼(Mo2C)负载金原子组成的高效催化体系,使水煤气中的CO和H2O在120℃下发生反应,反应微观模型如下图所示。
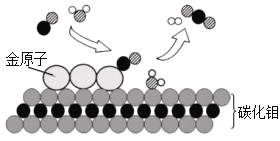
(1)反应微观模型中,除钼外还有______种元素,有_______种单质分子。
(2)该反应过程中:
①构成催化剂的各原子_______(填“有”或“没有”)变化。
②金原子对______(填“CO”或“H2O”)起吸附催化作用。
③反应的化学方程式为____________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】水分子的通电分解的微观示意图如下所示,从中我们可以获得许多信息.其中错误的是
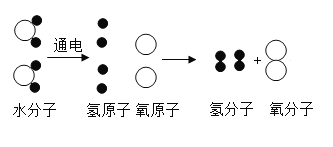
A.分解过程中元素种类没有发生变化
B.分解过程中水分子分解成氢原子和氧原子
C.生成的氢气和氧气的化学性质分别由氢原子和氧原子保持
D.在化学变化原子不可再分
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】写出下列反应的化学方程式并按要求填空:
(1)铜在空气中加热:_______,该实验观察到的实验现象是_______。
(2)丙烷(C3H8)在空气中完全燃烧:_______,与不完全燃烧相比,燃料发生完全燃烧的优点有_______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学兴趣小组为了测定鸡蛋壳中碳酸钙的含量,取一定质量洗净、粉碎后的鸡蛋壳样品放于烧杯中,向烧杯中滴加稀盐酸(整个过程不考虑盐酸的挥发和气体的溶解),实验测得烧杯中剩余物质的质量与加入盐酸的质量之间的关系如图所示。下列有关说法正确的是
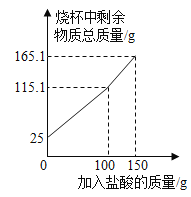
A.所取的鸡蛋壳样品的质量为125g
B.当滴入150g稀盐酸时,样品与稀盐酸恰好完全反应
C.反应完全后产生二氧化碳的质量为9.9g
D.该鸡蛋壳样品中碳酸钙的质量分数为80%
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】叠氮化钠(NaN3)被广泛应用于汽车安全气囊,某化学小组同学对其进行下列研究:
(查阅资料)
(1)NaN3遇盐酸、硫酸溶液无气体生成;
(2)碱石灰是CaO和 NaOH的混合物;
(3)NaN3的制备方法是:将金属钠与液态氨反应制得NaNH2,再将NaNH2与N2O反应可生成NaN3、NaOH和NH3。
(问题探究)
(1)汽车经撞击后,30毫秒内引发NaN3迅速分解生成两种单质,写出该反应的化学方程式_____。
(2)工业级NaN3中常含有少量的Na2CO3,其原因是(用化学方程式表示)_____。
(3)为测定某工业级NaN3样品中含有Na2CO3的质量分数,化学小组同学设计了如下实验装置:
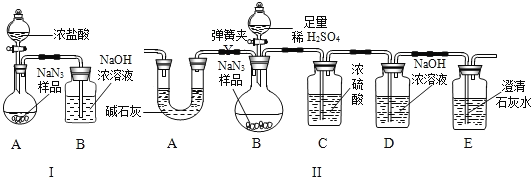
①小明同学认为通过测定装置 I中反应前后B的质量差,再通过相应计算,就可测定Na2CO3的纯度,小组内同学通过讨论认为不可以,其理由可能是_____。
②小刚同学在大家讨论的基础上,设计了装置II。请装置II中A的作用是_____;若无装置C,对测定结果造成的影响是_____(填“偏大”、“偏小”或“无影响”),装置E的作用是_____。
③根据装置II,小组同学设计的实验步骤有:a. 称量装置D;b. 称量样品,检查装置气密性;c. 打开弹簧夹,鼓入空气;d. 打开分液漏斗的活塞和玻璃塞,注入足量的稀硫酸,关闭活塞和玻璃塞。其正确顺序为_____(填字母序号,可重复)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com