
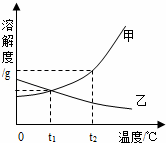
 如图是甲、乙两种固体物质的溶解度曲线.
如图是甲、乙两种固体物质的溶解度曲线.分析 (1)溶解度曲线的交点表示该温度下两物质的溶解度相等;
(2)据溶解度曲线的交点表示该温度下两物质的溶解度相等;
(3)不饱和溶液变为饱和溶液的一般方法是增加溶质、蒸发溶剂结合乙的溶解度随温度变化分析解答;
(4)根据配制一定溶质质量分数的溶液所需仪器进行解答.
解答 解:(1)由图可知:t1℃时,甲、乙两种物质的溶解度交于一点,二者的溶解度相等;
(2)由图可知:t1℃时,甲、乙两种物质的溶解度交于一点,二者的溶解度相等,t1℃时,100g水中溶解20g甲,溶液刚好饱和,故t1℃乙的溶解度为20g,那么50g水中溶解10g乙溶液达到饱和;
(3)乙的溶解度随温度的升高而逐渐减小,所以要使乙的不饱和溶液变为饱和溶液应升高温度;
(4)通常情况下,在实验室用固体甲配制一定溶质质量分数的甲溶液,需用到的仪器有:称量固体药品用的托盘天平(带砝码盒),溶解需要的烧杯,取药品的药匙,搅拌、加速溶解的玻璃棒,还需要量取液体的量筒和定容用的胶头滴管.
故答案为:(1)t1;(2)10g;(3)升高温度;(4)FG.
点评 掌握溶解度曲线的意义、不饱和溶液和饱和溶液的相互转化方法、配制溶液需要的仪器等知识,是解答问题的关键.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:解答题
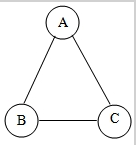 A、B、C是三种不同类别的含有氧元素的化合物,物质间相互反应的关系如图所示(图中“─”表示相连的两种物质能在溶液中发生反应).若B为纯碱,A、C间的反应为复分解反应,回答下列问题:
A、B、C是三种不同类别的含有氧元素的化合物,物质间相互反应的关系如图所示(图中“─”表示相连的两种物质能在溶液中发生反应).若B为纯碱,A、C间的反应为复分解反应,回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 碳酸→水+二氧化碳 | B. | 镁+氧气→氧化镁 | ||
| C. | 石蜡+氧气→二氧化碳+水 | D. | 酒精+氧气→二氧化碳+水 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 质子数、中子数 | B. | 中子数、最外层电子数 | ||
| C. | 质子数、最外层电子数 | D. | 电子数、质子和中子数 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 溶解度 | 10℃ | 20℃ | 30℃ | 40℃ |
| Na2CO3 | 12.5g | 21.5g | 39.7g | 49.0g |
| NaHCO3 | 8.1g | 9.6g | 11.1g | 12.7g |

| 装置B | 装置C | 装置D | |
| 实验前物质的质量/g | 180.0 | 200.0 | 122.2 |
| 实验后物质的质量/g | 176.9 | 201.5 | 124.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com