
【题目】如图表示实验室用稀H2SO4、CuO、Fe粉三种物质,制取铜的两种实验方案。

(1)若按方案1制取铜,步骤I的反应类型是_____。步骤II反应的现象是_____;
(2)若按方案2制取铜,步骤I发生反应的化学方程式_____,步骤II的实验操作中需要的玻璃仪器有玻璃棒、烧杯和_____。
(3)两种方案比较,方案_____更好,理由是:_____。
【答案】置换反应 黑色粉末逐渐变红,有水珠出现 CuO+H2SO4 ═CuSO4+H2O 漏斗 II 安全、节能
【解析】
(1)步骤I是铁与硫酸反应生成硫酸亚铁溶液和氢气,步骤II是氢气与氧化铜反应生成铜和二氧化碳,进行分析解答。
(2)步骤I是氧化铜与硫酸反应生成硫酸铜和水,进行分析解答。
(3)根据反应条件、操作是否安全方便等,进行分析解答。
(1)步骤I是铁与硫酸反应生成硫酸亚铁溶液和氢气,该反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的反应,属于置换反应。
步骤II是氢气与氧化铜反应生成铜和二氧化碳,步骤II反应的现象是黑色粉末逐渐变红,有水珠出现。
(2)步骤I是氧化铜与硫酸反应生成硫酸铜和水,反应的化学方程式为:CuO+H2SO4═CuSO4+H2O。
步骤II的实验操作是过滤,步骤II的实验操作中需要的玻璃仪器有玻璃棒、烧杯和漏斗。
(3)方案1中氢气与氧化铜反应需进行加热,两种方案比较,方案II更好,理由是安全、节能。


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:
【题目】硒元素具有抗衰老、抑制癌细胞生长的功能.其原子结构示意图及在元素周期表的信息如图,下列说法错误的是( )
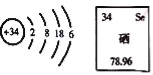
A.硒属于非金属元素 B.硒原子核内有34个质子
C.硒原子核外有4个电子层 D.硒的相对原子质量是78.96g
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】氯化亚铜(CuC1)是一种工业催化剂,不溶于水、乙醇(沸点是78.2℃)及稀硫酸熔点422℃,沸点1366℃,在空气中迅速被氧化成绿色。以粗盐水(含氯化钙、硫酸镁等杂质)、Cu、稀硫酸、SO2等为原料合成CuCl的工艺流程如图:
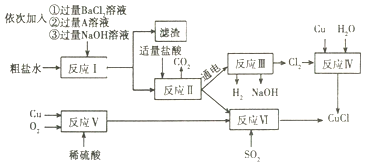
(1)反应I加入过量A溶液中溶质的化学式是___反应I中加入①②③三种试剂的顺序还可以是___(填写一种即可)。
(2)反应Ⅱ过程中发生中和反应的化学方程式是___。
(3)写出反应Ⅲ的化学方程式___。
(4)反应Ⅵ的化学方程式是:2NaCl+2CuSO4+SO2+2H20=2CuCl↓+2X+Na2SO4,则X的化学式为___该反应中化合价升高的元素是___。
(5)本工艺中可循环利用的物质是___。
(6)反应Ⅵ后,过滤得到的CuCl2沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70℃干燥2小时,冷却密封包装即得产品。70℃真空干燥的目的是___。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某无色气体X可能含有H2、CO、CO2和CH4中的一种或几种。为确认其组成,某同学 取一定量该气体按下图所示装置进行实验(假设每步都充分反应或吸收),结果装置①中变浑浊,装置③增重3.6g,装置④增重2.2g。关于气体X成分的①一定没有CO2;②一定有CO2,可能只有CH4;③一定有CO2,
可能含有CH4和H2;④一定有CO2,可能含有H2、CO和CH4。其中,正确的是
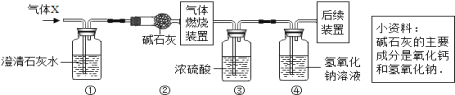
A. ①B. ②C. ③D. ④
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】铁是人体必需的微量元素。它在元素周期表中的部分信息及原子结构示意图如图所示,下列说法正确的是( )
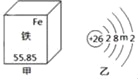
A. 乙图中m值为14
B. 铁的相对原子质量是55.85g
C. 铁原子中质子数是30
D. 铁原子在化学反应中易失去3个电子形成亚铁离子
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙两种固体(不含结晶水)的溶解度曲线如图所示,下列有关分析正确的是( )
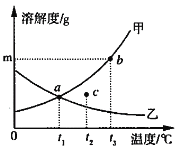
A. t1℃时,甲、乙两种溶液溶质质量分数相等
B. t3℃时,甲、乙两种饱和溶液中,溶剂的质量:乙 > 甲
C. t2℃时,c点所对应两种溶液的溶质质量分数:甲 >乙
D. 将t3℃时,甲、乙两种不饱和溶液降温到t1℃后,都能变为饱和溶液
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图所示,AE是初中化学常见的物质,A、D为两种黑色粉末,D与E反应后的生成物可用于配制波尔多液,C、E、F均含有三种元素,且分别为酸碱盐中的一种。用两圆.间的短线“-”表示两种物质可以发生化学反应,箭头“→”表示一种物质能转化为另一种物质。请回答下列问题:(以上反应均在初中范围内)
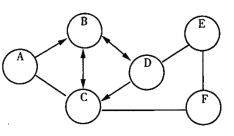
A 请写出C和D两种物质的化学式为:C_____,D_____;
B 写出D和E发生反应的化学方程式_____;
C 写出A转化为B反应的实验现象_____
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】兴趣小组用稀盐酸除去铁钉表面的铁锈(主要成分是Fe2O3),发现反应开始时铁锈消失,有气泡产生,溶液颜色为黄色,一段时间后变为浅绿色。
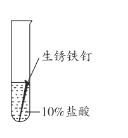
(查阅资料)FeCl3的溶液呈黄色
甲同学认为生成的FeCl3可能与试管中的物质继续反应,进行了下列实验。
实验编号 | 实验1-1 | 实验1-2 | 实验1-3 |
实验操作 |
|
|
|
实验现象 | 长时间放置,溶液颜色始终为黄色 | 长时间放置,溶液逐渐从黄色变浅绿色 | 长时间放置,产生红褐色沉淀 |
(1)用盐酸除铁锈的化学方程式为_________。
(2)实验1-1的目的是_________。
(3)综合分析实验1,溶液从黄色变浅绿色的可能原因是_________。
乙同学用生锈程度相同的锈铁钉、5mL盐酸探究溶液颜色变化的影响因素。
实验编号 | 所用试剂 | 实验现象 | |
反应开始时 | 24h后 | ||
2-1 | 铁锈和2%盐酸 | 铁锈、溶液均无明显变化 | 铁锈消失,溶液变黄色 |
2-2 | 生锈铁钉和2%盐酸 | 生锈铁钉、溶液均无明显变化 | 铁锈消失,溶液变浅绿色 |
23 | 生锈铁钉和6%盐酸 | 铁钉表面有少量气泡,铁锈逐渐消失,溶液逐渐由无色变浅黄色 | 溶液变为浅绿色 |
2-4 | 生锈铁钉和10%盐酸 | 铁钉表面产生大量气泡,铁锈逐渐消失,溶液很快由无色变黄色 | 溶液变为浅绿色 |
(4)生锈铁钉与盐酸反应时,溶液的颜色变化与________有关。
(5)2-2中始终未观察到溶液变黄色,结合实验1和实验2推测可能的原因为______。
(6)基于上述实验推测,下列关于工业用盐酸除铁锈的说法合理的是______(填字母 序号)。
A 除铁锈时,所用盐酸的浓度越大越好
B 在除锈过程中,生成的FeCl3对铁也有腐蚀作用
C 用盐酸除锈时,应注意控制反应的时间
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】有一包固体粉末,其中含有碳酸钠、氢氧化钠、碳酸钙、生石灰、氯化钠中的四种物质。某兴趣小组为确定其组成设计并进行如下实验。
(实验一)甲组同学进行如下探究。请完成表中空白。
实验操作 | 实验现象 | 实验结论及分析 |
Ⅰ.取少量该固体粉末于烧杯中,加入足量的水溶解、过滤 | 粉末部分溶解,得到白色滤渣和无色滤液 | 滤渣中一定含有_____ |
Ⅱ.向滤液中滴加无色酚酞试液 | 溶液变红 | 滤液中可能含有_____物质(填“酸性”“碱性”或“中性”) |
Ⅲ.向Ⅱ中所得溶液滴加足量稀盐酸 | _____ | 原固体粉末中一定含有Na2CO3 |
(实验二)乙组同学进行如下探究。
取21.0g该固体粉末,加入160.0g 10%的稀盐酸,恰好完全反应,实验测得产生8.8g二氧化碳,将反应后溶液继续蒸发结晶,得到固体,测定所得固体中含16.0g氯元素。
试综合甲、乙两组同学的实验进行分析,填空:
(1)乙组实验中一定发生的化学反应是:Na2CO3+2HCl═2NaCl+H2O+CO2↑
(2)固体粉末的组成中除Na2CO3外,一定还含有的物质是_____,可能含有的物质是_____(均填写化学式)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com