


科目:初中化学 来源:不详 题型:实验题
| 实验步骤 | 设计这一步骤的目的 | 实验现象 | 实验结论 |
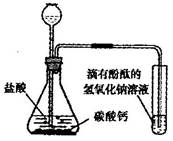
| 1.将NaOH溶液加热煮沸 | | 溶液变红,过一会儿红色消失 | 甲同学猜想_______(填“正确”或不正确”) |
| 2.向冷却后的溶液中滴人酚酞,并滴一些植物油在其上方 | |
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
| 实验方案 | 测溶液pH | 滴加Na2CO3溶液 | 滴加BaCl2溶液 |
| 实验操作 | 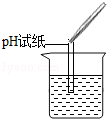 |  |  |
| 实验现象 | 试纸变色,对比比色卡,pH<7 | 。 | 产生白色沉淀 |
| 实验结论 | 溶液中有H2SO4 | 溶液中有H2SO4 | 溶液中有H2SO4 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题
| A.将气体分别通入澄清石灰水 | B.将气体分别通入石蕊溶液 |
| C.试验三种气体在水中溶解性 | D.用燃着的木条分别伸入瓶内 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
| 实验操作 | 实验现象 | 结论 |
| 取白色沉淀甲,滴加足量的稀盐酸 | 沉淀消失 | 白色沉淀甲中一定含有 |
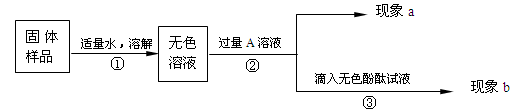
| 实验步骤 | 实验操作 | 实验现象 | 结论 |
| 1 | 取无色滤液乙,加入碳酸钠溶液 | 无明显现象 | 无色滤液乙中一定不含氯化钡 |
| 2 | 取适量无色滤液乙,加入过量的 溶液,过滤 | 生成白色沉淀 | 无色溶液中一定含有碳酸钠 |
| 3 | 取实验步骤2中的滤液,滴加 溶液 | | 原固体样品中一定存在氢氧化钠 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题

| 实验操作 | 实验现象 | 实验结论 |
| 取少量M溶液于试管中,向其中滴加酚酞 | | 猜想①正确 |
| 实验操作 | 实验现象 | 实验结论 |
| 分别取少量滤液于A、B两支试管中,A中加入CaCl2溶液,B中加入 溶液 | “猜想一”成立 | |
| | “猜想二”成立 | |
| | “猜想三”成立 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题

| 实验次数 | 1 | 2 | 3 | 4 | 5 |
| 抽气次数 | 42 | 38 | 36 | 44 | 40 |
| 二氧化硫的含量 | 是否超标 |
| | |

查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题

| 实验编号 | 10%红墨水溶液 | 同一规格除味剂 | 溶液褪色的时间 |
| ① | 10mL | 5g | 10min |
| ② | 10mL | 10g | 5min |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com