
某有机物在氧气中完全燃烧,生成二氧化碳和水的质量比为22:9,则该有机物可能是( )
|
| A. | C2H4 | B. | C12H22O11 | C. | C6H12O6 | D. | C2H5OH |
| 质量守恒定律及其应用;化合物中某元素的质量计算.. | |
| 专题: | 元素质量守恒. |
| 分析: | 根据二氧化碳和水的质量比为22:9,可计算出碳、氢两种元素的质量比为:(22×):(9×)=6:1,则碳氢的原子个数比是: =1:2. |
| 解答: | 解:根据二氧化碳和水的质量比为22:9,可计算出碳、氢两种元素的质量比为:(22× A、C2H4中碳氢两种原子个数比为1:2,故A正确; B、C12H22O11中碳氢两种原子个数比为6:11,故B错误; C、C6H12O6碳氢两种原子个数比为1:2,故C正确; D、C2H5OH中碳氢两种原子个数比为1:3,故D错误. 故选AC. |
| 点评: | 本题主要考查有关化学式的计算,难度较小.关键是要学会由物质质量求原子个数比的方法. |


科目:初中化学 来源: 题型:
下列图形能正确反映对应变化关系的是( )
| A | B | C | D |
|
|
|
|
|
| 加热一定量氯酸钾和二氧化锰混合物 | 在密闭容器中,甲烷完全燃烧 | 碳在盛有氧气的密闭集气瓶内燃烧 | 电解水 |
|
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:
据中央电视台6月3日对云南抚仙湖底古城考古的现场报道,科学家曾经通过测定古生物遗骸中的碳﹣14来推断古城年代.碳﹣14原子的核电荷数为6,质子数和中子数之和为14,下列关于碳﹣14原子的说法中错误的是( )
|
| A. | 质子数为6 | B. | 中子数为6 |
|
| C. | 电子数为6 | D. | 电子数和中子数之和为14 |
查看答案和解析>>
科目:初中化学 来源: 题型:
下列事实不能说明分子之间有间隔的是( )
|
| A. | 打气筒将空气压入自行车胎内 |
|
| B. | 空气受热体积膨胀 |
|
| C. | 氢气在氧气中燃烧生成水 |
|
| D. | 1体积酒精和1体积水混合小于2体积 |
查看答案和解析>>
科目:初中化学 来源: 题型:
在一定条件下,在一个密闭容器内发生某反应,测得反应过程中各物质的质量如下表所示,下列说法错误的是( )
| 物质 | a | b | c | d |
| 反应前质量(g) | 18 | 1 | 2 | 32 |
| 反应后质量(g) | 待测 | 26 | 2 | 12 |
|
| A. | 该反应是分解反应 |
|
| B. | d两种物质中元素种类一定与b物质中元素种类相同 |
|
| C. | c物质可能是该反应的催化剂 |
|
| D. | 反应中a、d的质量比为1:4
|
查看答案和解析>>
科目:初中化学 来源: 题型:
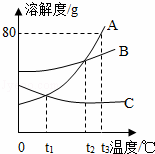
右图为A、B、C在水中的溶解度曲线图:
(1)A、C交点的意义是 ;
(2)t3℃时,A、B、C三者的溶解度由大到小的顺序是 ;若在该温度时将45克A放入50克水中,形成的溶液是 溶液;(填“饱和”或“不饱和”)所得溶液的质量分数为 ;
(3)如果有A、B的混合物(含少量的B),将A分离出来的方法是 ;
(4)t2℃时,等质量的A、B、C三种物质的饱和溶液,温度升高到t3℃,所得溶液溶质质量分数由大到小的顺序是: .
查看答案和解析>>
科目:初中化学 来源: 题型:
美国两位科学家利用碘元素,借助放射学进行了“G蛋白偶联受体”研究,揭开了“细胞如何感知周围环境”之谜,获得了2012年诺贝尔化学奖.图①和图②是碘元素在元素周期表中的部分信息及碘原子的结构示意图.请回答:
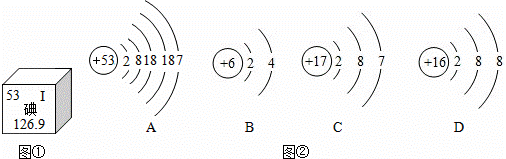
(1)由图①可知碘元素的一点信息是: ;
(2)A、B、C中与碘元素化学性质相似的是 (填字母);
(3)碘元素在元素周期表中排在第 周期;
(4)碘化镁的化学式是 .
查看答案和解析>>
科目:初中化学 来源: 题型:
小明同学对“锌与硫酸反应快慢的影响因素”进行了探究。
【提出 问题】锌与硫酸反应的快慢受哪些因素的影响呢?
问题】锌与硫酸反应的快慢受哪些因素的影响呢?
【猜想与假设】
a.可能与硫酸的质量分数有关;
b.可能与锌的形状有关。
【查阅资料】
锌的化学性质比较活泼,在常温下的空气中,表面生成一层“保护膜”,可阻止进一步氧化。该“保护膜”可以和酸反应,但不产生氢气。
【设计并实验】小兵用不同质量分数的硫酸和不同形状的锌进行如下实验。
| 实验编号 | 硫酸的质量分数(均取20mL) | 锌的形状(均取1g) | 氢气的体积(mL)(均收集3分钟) |
| ① | 20% | 锌粒 | 31.7 |
| ② | 20% | 锌片 | 50.9 |
| ③ | 20% | 锌粒 | 61.7 |
| ④ | 30% | 锌 | 79.9 |
(1)写出稀硫酸与锌反应的化学方程式______________________________。
(2)小兵用图装置收集并测量氢气的体积,其中量筒的作用是_______________________,
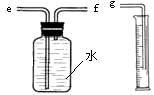 氢气应从________(填e或f或g)管通入;
氢气应从________(填e或f或g)管通入;
【收集证据】
(3)要比较不同质量分数的硫酸对反应快慢的影响,应选择的实验编号是____________;
【得出结论】
(4)结论是_____________________________________________________;
【评价与反思】
(5)下表是小兵第①组实验的详细数据。
| 时段(均为1分钟) | 第1分钟 | 第2分钟 | 第3分钟 | 第4分钟 | 第5分钟 | 第6分钟 |
| H2的体积 | 3.1mL | 16.7mL | 11. | 9.6mL | 7.6mL | 6.0mL |
请描述锌与硫酸反应的先慢后快最后又变慢的原因___________________________;
(6)你认为锌与硫酸反应的快慢可能还受 因素影响?
(7)取某厂生产的生铁样品6g,与100g足量的稀硫酸充分反应后,称得剩余物质的总质量为105.8g。
①生成气体的质量为 克;
②该厂生产的生铁样品中铁的质量分数是多少?(写出具体的过程,结果精确到0.1%)
③该厂生产的生铁是否合格? (填“合格”或“不合格”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com