
分析 分析所发生的反应,可发现反应后总质量减轻是由于生成了气体氢气,根据质量守恒定律可求出氢气的质量.然后利用氢气的质量,根据反应的化学方程式,计算恰好完全反应时锌的质量,最后使用质量分数的计算公式,求出铁合金中铁的质量分数.利用方程式即可求出反应的氯化氢的质量,进而可得稀盐酸溶液中溶质的质量分数.
解答 解:
由质量守恒定律定律可知该反应生成的氢气质量是:11.5g+100g-111.1g=0.4g;
设样品中Fe的质量为x,反应的氯化氢的质量是y
Fe+2HCl═FeCl2+H2↑
56 73 2
x y 0.4g
$\frac{56}{x}=\frac{73}{y}=\frac{2}{0.4g}$
x=11.2g
y=14.6g
(1)铁合金中铁的质量分数=$\frac{11.2g}{11.5g}×$100%≈97.3%;
(2)稀盐酸溶液中溶质的质量分数为:$\frac{14.6g}{100g}×$100%=14.6%
答案:
(1)铁合金中铁的质量分数为97.3%;
(2)稀盐酸溶液中溶质的质量分数为14.6%.
点评 根据化学方程式进行计算时,只能使用纯净物的质量进行计算,而不能把混合物的质量直接代入化学方程式进行计算,质量守恒定律在计算中的运用是化学计算的一个常见内容,一般的规律是依据质量的变化求出某一生成的质量,再结合反应方程式分析解答.


科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
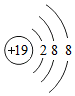 如图是钾离子的结构示意图,从图中可以获得的信息是C
如图是钾离子的结构示意图,从图中可以获得的信息是C查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
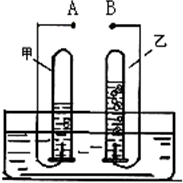 如图是电解水的简易装置图,回答下列问题.
如图是电解水的简易装置图,回答下列问题.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 稀盐酸--能与金属氧化物反应--除铁锈 | |
| B. | 苛性钠--容易吸收水分--作某些气体干燥剂 | |
| C. | 氧气--可燃性--气焊 | |
| D. | 碳酸氢钠--能与胃酸反应--治疗胃酸过多症 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com