


分析 探究Ⅰ:从含有硫酸铝、硫酸亚铁和硫酸铜的废水中回收铜和硫酸亚铁,加入的过量的金属A应是铁,根据铁与硫酸铜的反应写出①的反应的方程式,分析固体甲的成分及溶液乙中的溶质;
探究Ⅱ:【数据分析】(1)有无水硫酸铜粉末变蓝,说明产物中有水;
(2)根据化学反应前后原子种类和数目不改变;
(3)根据氧化铁的颜色、性质分析回答;
(4)根据质量守恒定律和化学式的意义进行计算.
【交流讨论】根据实验中要持续通入氮气的作用,分析x的变化.
解答 解:探究Ⅰ:由题意可知,从含有硫酸铝、硫酸亚铁和硫酸铜的废水中回收铜和硫酸亚铁,加入的过量的金属A应是铁.
(1)由上述分析可知,步骤①发生的反应是铁与硫酸铜的反应,化学方程式是:Fe+CuSO4═FeSO4+Cu.
(2)由于铁是过量的有剩余的铁,还有生成的铜.所以,固体甲中含有的物质是Fe、Cu;红色固体是Cu;由于铁不能与硫酸铝反应,所以溶液乙中的溶质是 Al2(SO4)3、FeSO4.
故答案为:(1)Fe+CuSO4═FeSO4+Cu.
(2)Fe、Cu;Cu;Al2(SO4)3、FeSO4.
探究Ⅱ:
【数据分析】
(1)图1装置B中无水硫酸铜粉末变蓝,质量增加12.6g,说明产物中有水,生成水的质量是12.6g.
(2)反应前后铁原子已经相等,所以X中不含铁原子,从化学方程式看反应前后X中含有一个硫原子和两个氧原子,故X是二氧化硫其化学式为SO2
(3)二氧化硫和三氧化硫都能和氢氧化钠反应生成相应的盐,故氢氧化钠溶液的作用就是吸收二氧化硫和三氧化硫,故答案:吸收二氧化硫和三氧化硫;
(4)由题意和图象可知,生成水的质量是12.6g,生成的氧化铁的质量是8g.
通过FeSO4•xH2O的化学式可知铁原子和水的个数比为1:x
Fe2O3~2xH2O
160 36x
8g 12.6g
$\frac{160}{8g}=\frac{36x}{12.6g}$
解得:x=7
故答案为:(1)水;12.6g;(2)SO2
(3)吸收二氧化硫和三氧化硫;(4)x=7;
【交流讨论】实验中要持续通入氮气,将生成的水蒸气全部排出,否则测出的x值会偏小,
故答案为:偏小.
点评 该题考查了学生从资料中获得有效信息的能力、实验分析能力、根据化学式的计算能力,综合性强考查知识全面.


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:初中化学 来源: 题型:解答题

 ,化学反应中该原子比较容易得到
,化学反应中该原子比较容易得到 表示的是Na+(填粒子符号);
表示的是Na+(填粒子符号);查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 为了探究二氧化碳的性质,某同学设计了如图所示的实验
为了探究二氧化碳的性质,某同学设计了如图所示的实验查看答案和解析>>
科目:初中化学 来源: 题型:解答题
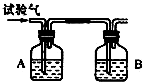 为了检验三种可燃性气体:C2H6(乙烷)、H2和CO(简称试验气),分别将它们在氧气中充分燃烧,把燃烧后生成的气体依次通过A、B两个洗气瓶(假设每瓶反应吸收完全),回答下列问题:
为了检验三种可燃性气体:C2H6(乙烷)、H2和CO(简称试验气),分别将它们在氧气中充分燃烧,把燃烧后生成的气体依次通过A、B两个洗气瓶(假设每瓶反应吸收完全),回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 0.8 g | B. | 1.6g | C. | 3.2 g | D. | 6.4 g |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com