
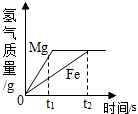
 将等质量的镁和铁分别放入等质量、等溶质的质量分数的稀盐酸中,产生氢气的质量与反应时间的关系如图所示,下列说法错误的是( )
将等质量的镁和铁分别放入等质量、等溶质的质量分数的稀盐酸中,产生氢气的质量与反应时间的关系如图所示,下列说法错误的是( )| A. | 反应结束后镁有剩余 | |
| B. | 反应消耗盐酸的总质量相等 | |
| C. | 0~t1时段,与镁反应的HCl的质量大 | |
| D. | 0~t2时段,参加反应的镁的质量与铁相等 |
分析 根据题意“将等质量的镁和铁分别放入等质量、相同质量分数的稀盐酸中”,通过图象可知金属镁和铁与酸反应的速率和生成氢气的质量,由此可推出金属活动性顺序,并结合化学方程式的计算可推出金属和酸的用量问题.
解答 解:A、如图最终生成的氢气质量相等,则消耗的盐酸质量相等,那么根据反应方程式可知Mg消耗得少、Fe消耗得多,已知根据“等质量的镁粉和铁粉”,因此镁一定有剩余,那么故A说法正确;
B、由图可知生成的氢气质量是相等的,则参加反应的盐酸的质量也是相等的,故说法正确;
C、由图可知,0-t1时段,产生氢气的质量曲线镁在铁的上方,即镁产生的氢气的比铁的多,与镁反应的HCl的质量大,故说法正确;
D、0-t2时段产生的氢气相等,而反应中生成氢气质量相等,根据反应方程式可知Mg消耗得少、Fe消耗得多,故说法错误.
故选:D
点评 本题考查金属与酸反应的有关知识,综合性较强,不仅需要根据图象和题意分析出直接信息,还需要根据计算得出用量问题.


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | Y<Z<X | B. | X<Y<Z | C. | Z<Y<X | D. | X<Z<Y |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 若甲、乙、丙分别是酸、碱、盐,则丁一定是水 | |
| B. | 甲、乙、丙、丁均是化合物,则该反应一定是复分解反应 | |
| C. | 若甲是一氧化碳,乙是金属氧化物,则丙一定是二氧化碳 | |
| D. | 若甲是锌,丙是氢气,则乙一定是稀硫酸 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
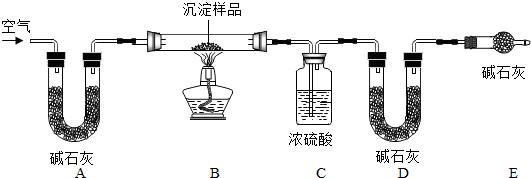
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
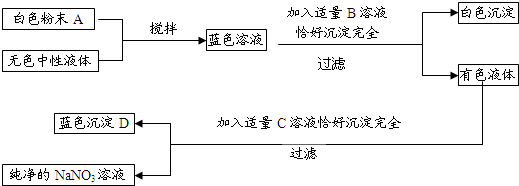
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com