
【题目】2020年面对突如其来的新型冠状病毒,越来越多的人意识到日常清洁消毒的重要性。医用酒精、84消毒液成为每个家庭必备的消毒用品。
交流与讨论一、关于酒精:
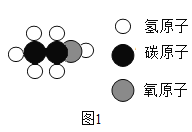
(1)下图是酒精(C2H5OH)分子的微观模拟图1,酒精的学名是_____,属于_____(填序号)。
A 化合物 B 氧化物 C 无机物 D 有机物
(2)酒精可作燃料,燃烧时放出大量的热,其化学反应方程式为_____,使酒精具备能燃烧这一性质的微粒是_____(填微粒名称);熄灭酒精灯时用灯帽盖灭,依据的灭火原理是_____。
(3)酒精是可再生能源,利用农作物秸秆生产酒精的主要流程如图2所示,请回答下列问题:
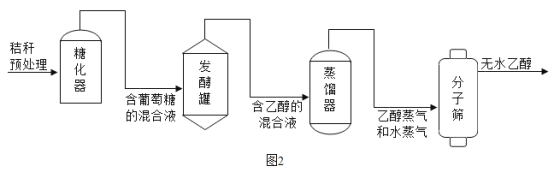
发醇罐中,葡萄糖(C6H12O6)在酒化酶的催化作用下发生反应的化学方程式为:C6H12O6 2C2H5OH+2X↑,则X的化学式为_____,该反应属于_____反应(填基本反应类型)。
2C2H5OH+2X↑,则X的化学式为_____,该反应属于_____反应(填基本反应类型)。
(4)医用体积分数75%的酒精溶液作消毒剂,此酒精溶液的溶剂是_____(填物质名称)。
[查阅资料]配制100mL医用酒精,可以量取79mL 95%的酒精溶液,并加水稀释至100mL。
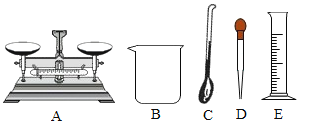
I.量取75mL 95%的酒精溶液,可选用的仪器是_____(如图所示,填序号)。
Ⅱ.小明将79mL 95%酒精溶液和21mL蒸馏水混合,发现体积小于100mL,请用微粒的观点解释其原因_____。
Ⅲ.在老师的指导下,小明选用容量瓶(可精确地配制一定浓度溶液的仪器)79mL 95%的酒精溶液并加水至10mL刻度配制75%的酒精溶液。
交流与讨论二、关于“84消毒液”:
“84消毒液”说明书上的部分信息如下:
主要成分:NaClO
杂质成分:NaCl、NaOH
净含量:500mL
主要性能:具有碱性、漂白性和腐蚀性
保存方法:密封、避光、低温保存
使用范围:适用于一般物体的表面消毒
注意事项:不可与其他洗涤剂或消毒液混合使用
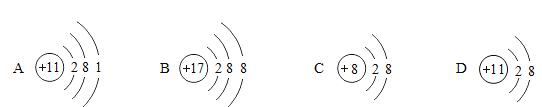
(1)NaCl、NaClO、NaOH中阳离子的结构示意图为_____(填序号)。
(2)常温下,该消毒液的pH_____(填序号)。
A 大于7
B 等于7
C 小于7
(3)工业上将氯气(Cl2)通入烧碱溶液中可制取消毒液,反应后形成了NaCl和NaClO的溶液,该反应的化学方程式为_____。
(4)“84消毒液”(主要成分是NaClO) 和洁厕剂(主要成分是盐酸) 混合使用会产生有毒气体,可能导致中毒,小美猜想有毒气体可能是氯气,她猜想的依据是_____。
(5)探究NaClO的漂白性
[查阅资料]
次氯酸钠(NaClO) 能与水反应,水溶液能释放氧气,反应的过程为NaClO+H2O=HClO+NaOH;2HClO![]() 2HCl+O2↑,该过程中化合价发生变化的元素有_____,次氯酸(HClO) 能使染料和有机色质褪色,可用作漂白剂。
2HCl+O2↑,该过程中化合价发生变化的元素有_____,次氯酸(HClO) 能使染料和有机色质褪色,可用作漂白剂。
[进行实验]选用红色纯棉布条进行如图实验:
编号 | ① | ② | ③ | ④ |
实验操作 |
|
|
|
|
5min后 | 布条略变浅 | 布条变为粉色 | 布条变为粉色 | 布条变为乳黄色 |
[解释与结论]
I.实验中,欲得出“其他条件相同时,升高温度可使次氯酸钠溶液的漂白性增强”的结论,需要对比_____。
实验(填编号):
Ⅱ.试分析实验④应控制的温度条件及设计该实验的目的是_____。
Ⅲ.根据实验,请你再提出一条使用“84消毒液”消毒时的注意事项_____。
【答案】乙醇 AD 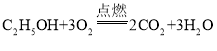 乙醇分子 可燃物与氧气隔绝 CO2 分解反应 水 DE 分子之间有间隔 D A Cl2+2NaOH=NaCl+NaClO+H2O 化学反应前后元素种类不变,反应物中含有氯元素,所以有毒气体为氯气 Cl、O ①③ 20℃时探究稀醋酸对次氯酸钠漂白性的影响 有颜色衣物不宜使用84消毒液消毒
乙醇分子 可燃物与氧气隔绝 CO2 分解反应 水 DE 分子之间有间隔 D A Cl2+2NaOH=NaCl+NaClO+H2O 化学反应前后元素种类不变,反应物中含有氯元素,所以有毒气体为氯气 Cl、O ①③ 20℃时探究稀醋酸对次氯酸钠漂白性的影响 有颜色衣物不宜使用84消毒液消毒
【解析】
交流与讨论一、关于酒精:
(1)酒精俗称为乙醇,含有碳氢氧三种元素,所以是化合物,同时含有碳元素,因此还是有机物;
故答案为:乙醇;AD;
(2)酒精与氧气在点燃条件下反应生成水和二氧化碳,书写化学方程式注意配平;参与反应的是分子,因此具有燃烧性的为乙醇分子;灯帽覆盖后,可燃物酒精与氧气隔绝,所以燃烧停止,变为熄灭;
故答案为: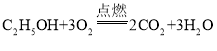 ,乙醇分子,可燃物与氧气隔绝;
,乙醇分子,可燃物与氧气隔绝;
(3)根据质量守恒定律,化学反应前后,原子的种类和数目不变,反应物中含6个碳原子、12个氢原子、6个氧原子,生成物中含4个碳原子、12个氢原子、2个氧原子,故生成物中还应有2个碳原子和4个氧元素,而X系数为2,所以X为二氧化碳;由一种反应物生成多种生成生成物,所以符合分解反应特点;
故答案为:CO2;分解反应;
(4)酒精溶解在水中,形成75%的医用酒精,所以溶剂为水;
故答案为:水;
[查阅资料]
Ⅰ:量取酒精液体时,需要用量筒进行量取,同时在接近所需体积时,需要胶头滴管滴加至所需体积;
故答案为:DE;
Ⅱ:分子之间有间隔,所以当两者分子混合后,会进入间隔中,使体积减小;
故答案为:分子之间有间隔;
交流与讨论二、关于“84消毒液”:
(1))NaCl、NaClO、NaOH中阳离子为钠离子,阳离子中核内质子数大于核外电子数,只有D符合要求;
故答案为:D;
(2)杂质有氢氧化钠,所以溶液显碱性,pH大于7;
故答案为:A;
(3)氯气与氢氧化钠反应生成了氯化钠和次氯酸钠,还缺少氢元素,没有气体生成,因此可以组合生成水,所以氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水,据此书写化学方程式;
故答案为:![]() ;
;
(4)次氯酸钠与盐酸反应生成有毒气体,根据含有的元素,可以看出能生成有毒气体只有氯元素,生成氯气;
故答案为:化学反应前后元素种类不变,反应物中含有氯元素,所以有毒气体为氯气;(5)根据化学方程式,可以看出氯元素由+1变为﹣1,氧元素由﹣2变为0,所以发生化合价变化的为氯和氧元素;
故答案为:Cl、O;
[解释与结论]
Ⅰ:根据对比实验要求,找到温度升高的两组实验即可,①和③只有温度一个变量,其他实验条件一致,因此可以得出实验结论温度对漂白性强弱的影响;
故答案为:①③;
Ⅱ:④中除了加入稀醋酸,与其他实验相比,以及存在变量,所以要保证其他条件不变,所以选择温度一致浓度相同的②做对比实验,所以温度应该一致为20℃,探究变量醋酸的影响;
故答案为:20℃时探究稀醋酸对次氯酸钠漂白性的影响;
Ⅲ:根据实验次氯酸钠具有漂白性,因此有颜色的衣物不得用84消毒液进行消毒,否则会褪色;
故答案为:有颜色衣物不宜使用84消毒液消毒。


科目:初中化学 来源: 题型:
【题目】为了探究金属与酸反应的规律,某实验小组进行了如图实验,取等质量的铁片、镁片、锌片,分别与等体积、等浓度的稀盐酸反应,用温度传感器测得反应温度变化曲线如图所示。下列有关说法错误的是( )
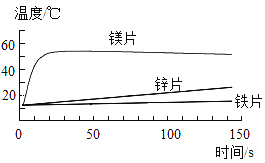
A.温度升高的原因是金属与酸反应放出热量
B.50s时铁反应放出的热量最少
C.由图象可得金属性强弱的顺序Mg>Zn>Fe
D.反应结束三种金属产生气体质量一定相等
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某校初三学生去西樵山春游,带回了几块石灰石样品。为了检测样品中碳酸钙的含量,甲、乙、丙、丁四位同学用质量分数相同的盐酸与样品充分反应来进行测定![]() 假设样品中的杂质不溶于水,且不与盐酸反应
假设样品中的杂质不溶于水,且不与盐酸反应![]() ,测得数据如表:
,测得数据如表:
甲 | 乙 | 丙 | 丁 | |
均匀研磨后的石灰石样品质量 |
|
|
|
|
盐酸的质量 |
|
|
|
|
剩余固体的质量 |
|
|
|
|
试问答:
(1)![]() 样品与
样品与![]() 盐酸充分反应后,盐酸是否有剩余______
盐酸充分反应后,盐酸是否有剩余______ ![]() 填“是”或“否”
填“是”或“否”![]() ;样品中碳酸钙的质量分数是______。
;样品中碳酸钙的质量分数是______。
(2)计算所用盐酸的质量分数![]() 写出计算过程
写出计算过程![]()
(3)画出![]() 样品与
样品与![]() 盐酸混合后产生二氧化碳的质量与盐酸的关系图。
盐酸混合后产生二氧化碳的质量与盐酸的关系图。

查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】请结合图示实验装置,回答下列问题。

(1)实验室用高锰酸钾制取氧气的化学方程式为_______,A装置试管口塞一团棉花的原因是_______。收集氧气可以选用_______(从C、D、E装置中选择)装置。
(2)实验室使用B装置制取二氧化碳的突出优点是_______。将制得的二氧化碳通入紫色石蕊溶液中,观察到的现象是_______。
(3)某氢气中混有少量的水蒸气,欲使用F、G装置除去少量的水蒸气并收集氢气,则装置的连接顺序为_______(用端口字母表示)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】四种物质在一定的条件下充分混合反应,测得反应前后各物质的质量分数如图所示。则有关说法中错误的是( )
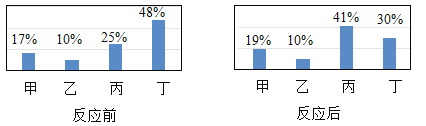
A.丁是化合物
B.乙可能是这个反应的催化剂
C.参加反应的丁的质量一定等于生成甲和丙的质量之和
D.反应过程中丁、丙两物质的质量比为5:8
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学实验是学生运用化学知识、拓展化学思维和培养化学素养的重要途径。下列实验能达到目的的是
A.滴加液体![]() B.称量固体NaOH
B.称量固体NaOH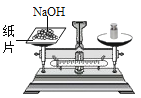
C.稀释浓硫酸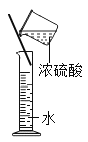 D.收集氢气
D.收集氢气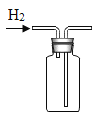
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列各组物质间能通过一步反应就能实现如图转化的是( )
X | Y | Z | |
A | Fe | FeCl2 | Fe2O3 |
B | O2 | CuO | Cu |
C | AgNO3 | Ba(NO3)2 | BaSO4 |
D | Ca(OH)2 | NaOH | H2O |

A. AB. BC. CD. D
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】铝、镁等金属在生产生活中有广泛的应用。
(一)铝制品的应用
(1)Cu、Fe、Al三种金属的活动性由强到弱的顺序是______。
(2)用玻璃钢、铝合金等材料可制成某火箭整流罩,以上叙述中不涉及到______(选填字母)。
A无机材料 B合成材料 C复合材料
(3)焊接铁轨时,铝与氧化铁在高温下生成铁和氧化铝,该反应的化学方程式______。
(4)铝制成铝箔作食品包装,是利用它的______。(选填字母)。
A导热性 B延展性 C导电性
(二)氧化铝的制备
活性氧化铝可用作化学反应的催化剂。某炼钢厂的工业废渣中主要含有Al2O3、Fe2O3、SiO2,对该废渣进行处理来获取活性氧化铝,其流程如图:
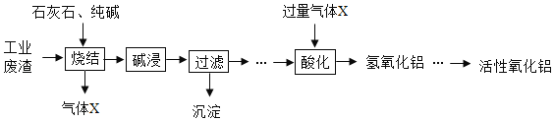
(1)将工业废渣研磨成粉末的目的是______。
(2)气体X的化学式______。
(3)碱浸过程中,烧结生成的NaFeO2可与水反应生成NaOH和另一种碱,该含铁化合物为______。
(三)探究铝碳酸镁的组成
铝碳酸镁[AlxMgy(OH)zCO3aH2O]可用于治疗胃酸过多。某兴趣小组取一定量该药片用如图装置探究其组成。
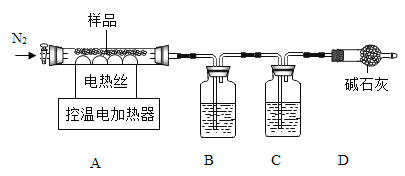
(资料)①Al2(SO4)3+6NaOH=2Al(OH)3↓+3Na2SO4,Al(OH)3+NaOH=NaAlO2+2H2O.
②Mg(OH)2不溶于NaOH,NaAlO2极易溶于水。
(1)装配好实验装置后,先要______。
(2)铝碳酸镁加热分解为Al2O3、MgO、CO2和水,装置B和C中盛放的药品应选择:______。
A浓NaOH溶液、浓H2SO4B浓H2SO4、浓NaOH溶液
(3)实验开始前通入一定量氮气,目的是______。
(4)充分加热后,测得装置B增重2.16g,装置C增重0.44g。另取等质量的样品加入一定量稀硫酸充分反应后滤去不溶物,向滤液中逐渐加入足量的稀NaOH溶液,产生沉淀的物质的质量与加入NaOH质量的关系如图。
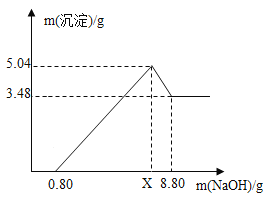
①图中NaOH加入0.80g,仍没有沉淀,说明滤液中含______。
②X值为______。
③x:y:z=______。
④写出铝碳酸镁治疗胃酸过多的化学方程式______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】回答下列与金属有关的问题。
(1)生铁片与纯铁片相互刻画时,在_____片会留下划痕;
(2)铁粉用于制作“暖宝宝”利用铁粉能与氧气和____反应放出热量;
(3)用赤铁矿炼铁的核心反应的化学方程式为______,其中____发生了氧化反应;
(4)向AgNO3、Cu(NO3)2和KNO3的混合溶液中加入一定量的Zn粉,充分反应后过滤,得到金属滤渣和无色滤液,则滤渣中一定含有的金属是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com