

分析 (1)反应后剩余物的总质量比反应前的减少,根据质量守恒定律知,减少的质量就是生成二氧化碳的质量;
(2)根据二氧化碳的质量,依据化学方程式为计算参加反应的碳酸钙的质量,然后计算质量分数.
解答 解:(1)由质量守恒定律可知生成的二氧化碳质量是:12.5g+40.5g-48.6g=4.4g;
(2)解:设鸡蛋壳中碳酸钙的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 4.4g
$\frac{100}{x}$=$\frac{44}{4.4g}$
x=10g
鸡蛋壳中碳酸钙的质量分数为:$\frac{10g}{12.5g}$×100%=80%.
答:鸡蛋壳中碳酸钙的质量分数为80%.
故答案为:(1)4.4g;
(2)80%.
点评 解答本题的关键是要知道固体质量的减少量就是生成二氧化碳的质量;根据气体的质量算出碳酸钙和氯化钙的质量,再计算质量分数即可.


科目:初中化学 来源: 题型:解答题
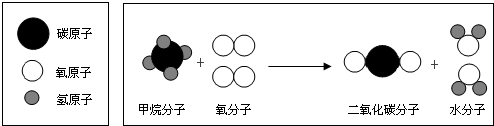
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 硫燃烧发出蓝色火焰,放热,生成有刺激性气味的气体 | |
| B. | 红磷在氧气中燃烧产生白雾,放出大量的热 | |
| C. | 木炭燃烧生成二氧化碳,放出热量 | |
| D. | 铁丝在氧气中燃烧火星四射,放热,生成黑色固体 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
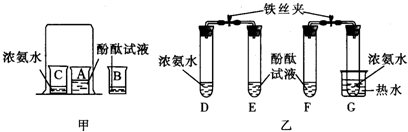
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
 蜡烛是由石蜡和棉线芯组成的.某同学在做蜡烛燃烧的探究实验时,用火柴去点蜡烛刚熄灭时产生的白烟(如图所示),他惊奇地发现蜡烛又能重新燃烧起来.由此,他大胆地做了一个推测,此白烟是( )
蜡烛是由石蜡和棉线芯组成的.某同学在做蜡烛燃烧的探究实验时,用火柴去点蜡烛刚熄灭时产生的白烟(如图所示),他惊奇地发现蜡烛又能重新燃烧起来.由此,他大胆地做了一个推测,此白烟是( )| A. | 氧气 | B. | 二氧化碳 | ||
| C. | 一氧化碳 | D. | 石蜡的固体小颗粒 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com