

分析 (1)实验室制取二氧化碳一般采用石灰石及盐酸制取.
(2)盐酸与硝酸银反应会生成白色沉淀.
(3)验证二氧化碳的存在一般采用澄清石灰水完成.
(4)收集一瓶纯净、干燥的二氧化碳气体时一般是先纯净后干燥.
解答 解:(1)也就是书写碳酸钙与盐酸的反应,故答案为:CaCO3+2HCl═CaCl2+H2O+CO2↑;
(2)盐酸与硝酸银反应会生成白色的氯化银沉淀,故答案为:有白色沉淀产生;AgNO3+HCl═AgCl↓+HNO3;
(3)验证二氧化碳的存在一般是用澄清石灰水完成,故答案为:C;
(4)制取纯净气体需先把可能混有的氯化氢气体除掉而后进行干燥,故答案为:A、E、B、D;吸收CO2中的水分.
点评 此题是对二氧化碳实验室制取有关问题的考查,涉及到二氧化碳除杂与干燥,得到了干燥气体一般放于最后的知识,是一道考查基础的好题.


科目:初中化学 来源: 题型:解答题
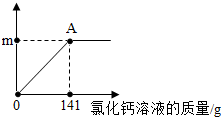 家里蒸馒头的纯碱中含有少量的氯化钠.为测定该纯碱中碳酸钠的质量分数:取该样品11g,全部溶液在100g水中,再逐渐滴加氯化钙溶液,反应的情况如图所示,A点时,过滤,得到滤液242g.(反应方程式:Na2CO3+CaCl2═CaCO3↓+2NaCl)计算:
家里蒸馒头的纯碱中含有少量的氯化钠.为测定该纯碱中碳酸钠的质量分数:取该样品11g,全部溶液在100g水中,再逐渐滴加氯化钙溶液,反应的情况如图所示,A点时,过滤,得到滤液242g.(反应方程式:Na2CO3+CaCl2═CaCO3↓+2NaCl)计算:查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 小苏打NaHCO3 | B. | 水煤气CH4 | C. | 铁锈Fe2O3•xH2O | D. | 水银Hg |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 物质 | NaCl | NaHCO3 | NH4Cl | NH3 | CO2 |
| 溶解度 | 36.0g | 9.6g | 37.2g | 710 | 0.9 |
| 实验步骤 | 实验现象 | 实验结论 |
| ①取少量滤液于试管中,滴加稀盐酸 | 产生无色无味气体 | 说明滤液中含有的物质是NaHCO3 |
| ②另取少量滤液于试管中,滴加足量稀HNO3后,再滴加AgNO3溶液 | 产生白色沉淀 | 证明滤液中含有NaCl |
| 第一组 | 第二组 | 第三组 | 第四组 | |
| CaCl2溶液的质量(克) | 100 | 200 | 300 | 400 |
| 产生沉淀的质量(克) | 8 | 16 | 20 | 20 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

| 反应前(g) | 反应后(g) | |
| B | 100 | 105.4 |
| C | 150 | 163.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com