
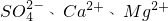 的形式存在,为将这些杂质离子除净,应加入过量的氯化钡、氢氧化钠、碳酸钠等物质将其转化为沉淀,过滤除去;再加入适量的盐酸,得到精盐水,最后经蒸发即得精盐.以下是某化工厂对海水进行综合利用的示意图1:
的形式存在,为将这些杂质离子除净,应加入过量的氯化钡、氢氧化钠、碳酸钠等物质将其转化为沉淀,过滤除去;再加入适量的盐酸,得到精盐水,最后经蒸发即得精盐.以下是某化工厂对海水进行综合利用的示意图1:



 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
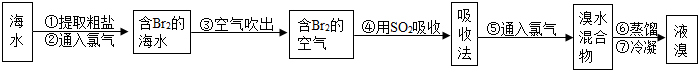
 试回答:
试回答:| 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | |
| 氯化钠 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| 碳酸氢铵 | 15.8 | 21.0 | 27.0 | ||
| 碳酸氢钠 | 8.1 | 9.6 | 11.1 | 12.7 | |
| 氯化铵 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 1 |
| 3 |
| 温度 溶解度/g 盐 |
10℃ | 20℃ | 30℃ | 40℃ | 50℃ |
| 氯化钠 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| 碳酸氢铵 | 15.8 | 21.0 | 27.0 | ------- | ------- |
| 碳酸氢钠 | 8.1 | 9.6 | 11.1 | 12.7 | ------- |
| 氯化铵 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 1 |
| 3 |
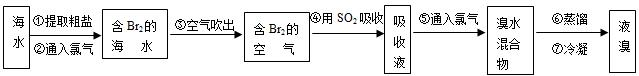
| 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | |
| 氯化钠 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| 碳酸氢铵 | 15.8 | 21.0 | 27.0 | ||
| 碳酸氢钠 | 8.1 | 9.6 | 11.1 | 12.7 | |
| 氯化铵 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| O | 2- 4 |


查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com