
分析 中和反应是酸与碱作用生成盐和水的反应,中和反应的实质是H++OH-=H2O,据此结合中和反应的应用,进行分析解答.
解答 解:中和反应是酸与碱作用生成盐和水的反应,中和反应的实质是氢离子和氢氧根离子结合生成水分子,即H++OH-=H2O.
酸碱发生中和反应生成盐和水,在工农业生产和日常生活中都有重要的应用.如可用氢氧化铝来治疗胃酸过多;用氢氧化钙来改良酸性土壤;用酸碱溶液来处理工厂排放的酸碱性不达标的废水等.
故答案为:氢离子和氢氧根离子结合生成水分子;用氢氧化铝来治疗胃酸过多(合理即可).
点评 本题难度不大,掌握酸碱中和反应的原理、实质(H++OH-=H2O)、应用是正确解答本题的关键.


科目:初中化学 来源: 题型:解答题
| 实验次序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 双氧水溶液的 溶质质量分数 | 1% | 3% | 5% | 10% | 15% | 20% | 25% | 30% |
| MnO2 粉末的 质量(克) | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 |
| 收集500 ml气体 所用的时间(秒) | 660 | 220 | 205 | 80 | 25 | 9 | 4 | 3 |
| 反应后溶液的温度(℃) | 24 | 34 | 39 | 65 | 70 | 79 | 85 | 90 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
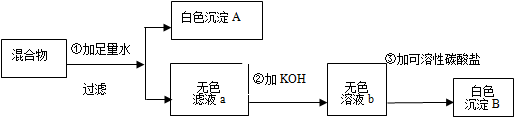
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 盐酸 | B. | 食盐水 | C. | 澄清石灰水 | D. | 蒸馏水 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
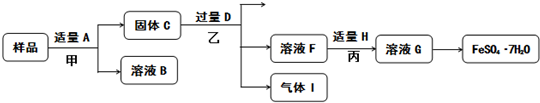
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com