
A-K 是初中化学常见的物质,其中化合物 F 为铁锈的主要成分。它们之间的相互关系如图所示(部分反应物、生成物、反应条件已略去,假设每步反应恰好完全反应)

请回答下列问题:
物质A 的名称____。
⑴反应②属于____反应(填基本反应类型)。
⑵若 K 为AgCl,则 X 为_____(填化学式);若 K 为 BaSO4,则 Y 为___(填化学式)。
⑶反应③的化学方程式为___________;
反应④的化学方程式为__________________。
⑷反应⑤的现象为________________。
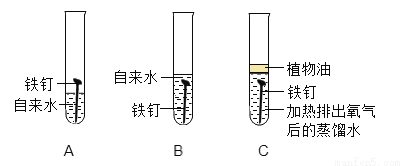
⑸将相同的铁钉同时放入下列装置中进行实验,大约一周时间后,将铁钉取出烘干,其中质量最小的是 ____(填标号)。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源:山东省临沂市郯城县2018届九年级第一次模拟考试化学试卷 题型:简答题
47.2017年世界环境日中国的主题是“绿水青山就是金山银山”
(1) 减少污染物排放——空气清新
引起酸雨的主要物质是_________,低碳生活可以减缓________引起的温室效应。
(2)自来水来之不易——节约用水
自来水生产流程:  通常加入__________吸附水中的异味和色素,氯气的作用是_________________。
通常加入__________吸附水中的异味和色素,氯气的作用是_________________。
(3)清洁高效能源——天然气
天然气的主要成分是甲烷,燃烧的化学方程式是_____________________________。
SO2 CO2 活性炭 消毒 CH4 + 2O2 CO2 +2H2O 【解析】本题考查了自来水的生产过程与净化方法,二氧化碳对环境的影响,酸雨的产生,甲烷的燃烧。难度不大依据已有的知识进行分析。 (1)引起酸雨的主要物质是二氧化硫(SO2),低碳生活可以减缓二氧化碳(CO2)引起的温室效应; (2)活性炭具有吸附性。自来水生产流程中通常加入活性炭吸附水中的异味和色素,氯气能杀死水...查看答案和解析>>
科目:初中化学 来源:山东省淄博市(五四制)2017-2018学年八年级下学期期中考试化学试卷 题型:单选题
一个密闭容器中放入X、Y、Z、Q四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表,则关于此反应认识错误的是( )

A. 物质Z可能是该反应的催化剂 B. 反应后物质X的质量为15g
C. 反应中Y、Q的质量比为6:5 D. 物质Y一定是单质
D 【解析】根据质量守恒定律,反应前各物质的质量总和=反应后各物质的质量总和,设未测值为a,则20+2+1+37=a+32+1+12,a=15;反应后质量增加的物质是生成物,反应后质量减小的物质是反应物,反应前后质量没有变化的物质可能是催化剂。A、物质Z的质量在反应前后不变,可能是该反应的催化剂,正确;B、由分析知,反应后物质X的质量为15g,正确;C、反应中Y、Q的质量比为(32-2)g:...查看答案和解析>>
科目:初中化学 来源:福建省九年级学业质量检查化学试卷 题型:填空题
2017年十大“科学”流言之一“紫菜是塑料薄膜制成的”, 网传认为有些紫菜是用黑色聚氯乙烯塑料薄膜制作的,曾一度引起公众热议。专家辟谣紫菜含有蛋白质、糖类、维生素、碘等丰富的营养成分,与塑料完全不同。
(1)塑料薄膜属于_________(填“天然”或“合成”)有机高分子材料。
(2)紫菜含碘量高,可用于治疗因缺碘引起的 _____________ 。
(3)可用燃烧法鉴别紫菜与聚氯乙烯塑料,点燃时闻到强烈刺激性气味是_______。
(4)废弃的塑料进入自然环境后难以降解,造成的环境问题是_______(写一点)。
(5)聚氯乙烯[(CH2CHCl)n,n为正整数]中氯元素的质量分数为____(列计算式)。
合成 甲状腺肿大(或甲状腺疾病等或其它合理答案) 聚氯乙烯塑料 白色污染(或其它合理答案) 35.5n/n(12+1×2+12+1+35.3)×100% 【解析】(1)塑料薄膜属于合成有机高分子材料,塑料,橡胶,合成纤维均属于合成有机高分子材料。(2)紫菜含碘量高,可用于治疗因缺碘引起的甲状腺肿大,缺碘会引起的甲状腺肿大。(3)可用燃烧法鉴别紫菜与聚氯乙烯塑料,点燃时闻到强烈刺激性气味是聚氯...查看答案和解析>>
科目:初中化学 来源:福建省九年级学业质量检查化学试卷 题型:单选题
如图是硫元素在元素周期表中的信息和硫原子结构示意图。下列说法不正确的是

A. 在硫原子结构示意图中,a=2、b=8
B. 在化学反应中硫原子得到2个电子形成S2-
C. 硫原子中,质子数=核外电子数=16,则X=16
D. 硫的相对原子质量为32.06g
D 【解析】根据所学知识和题中信息知,A、在硫原子结构示意图中,a=2、b=8,故A正确;B、在化学反应中硫原子得到2个电子形成S2-,最外层6个电子,大于4,易得电子,故B正确;C、硫原子中,质子数=核外电子数=16,则X=16,故C正确;D、硫的相对原子质量为32.06,没有单位,故D错误。 点睛∶原子核内质子数等于核外电子数等于原子序数。相对原子质量没有单位。查看答案和解析>>
科目:初中化学 来源:广东省深圳市盐田区2018届九年级中考第一次模拟考试化学试卷 题型:单选题
有特殊气味的乙硫醇(C2H5SH)常被加入燃气中以检测燃气泄漏,其燃烧反应为: 2C2H5SH+9O2 4X+6H2O+2SO2 ,下列关于X的说法正确的是( )
4X+6H2O+2SO2 ,下列关于X的说法正确的是( )
A. 乙硫醇是一种无机硫化物 B. 乙硫醇中C、H 原子个数比为 2:5
C. 化学方程式中X 为 CO 气体 D. 乙硫醇中碳、硫元素的质量比为 3:4
D 【解析】A、根据乙硫醇化学式可知,乙硫醇是含碳的化合物属于有机化合物,错误;B、根据乙硫醇化学式可知,乙硫醇中C、H 原子个数比= 2:6,错误;C、由题干中的化学方程式可知:方程式的左边有4个碳原子、12个氢原子、2个硫原子和18个氧原子,右边有2个硫原子、12个氢原子、10个氧原子和4个X分子。根据质量守恒定律中元素种类不变、原子个数不变的特点可知:4个X分子含有4个碳原子和8个氧原...查看答案和解析>>
科目:初中化学 来源:云南省开远市2018届九年级学业水平复习统一检测化学试卷 题型:计算题
为确定失去标签的盐酸溶液中溶质的质量分数,某化学兴趣小组进行了实验探究,化学小组同学取50g该盐酸溶液,向其中加入50g硝酸银溶液,二者恰好完全反应,过滤后称得滤液的质量为85.65g。(温馨提示:HCl+AgNO3= AgCl↓+HNO3) 请计算:
(1)反应后生成沉淀的质量;
(2)该盐酸溶液中溶质的质量分数。(计算结果精确到0.1%)
(1)14.35g (2)7.3% 【解析】根据质量守恒定律及反应的化学方程式计算解答。(1)反应后生成沉淀的质量=50g+50g-85.65g=14.35g (2)设盐酸中溶质的质量为y。 HCl+AgNO3= AgCl↓+HNO3 36.5 143.5 x 14.35g x=3.65g 该盐酸溶液中溶质的质量分数=×100%=7.3% 答:(1)...查看答案和解析>>
科目:初中化学 来源:云南省开远市2018届九年级学业水平复习统一检测化学试卷 题型:单选题
酒精灯的火焰太小时,将灯芯拨得松散一些,可能火焰更旺,其原理是
A. 降低可燃物的着火点
B. 提高可燃物的着火点
C. 增加空气中氧气含量
D. 增大可燃物与空气的接触面积
D 【解析】试题分析:燃烧需要同时具备的三个条件:物质有可燃性、温度达可酒精灯的火焰太小时,将灯芯拨得松散一些,可能火焰更旺,其原理是燃物的着火点、与氧气充分接触;促进燃烧的方法有增大可燃物与氧气的接触面积,提高氧气的浓度。增大可燃物与空气的接触面积查看答案和解析>>
科目:初中化学 来源:江苏省南通市市区2018届九年级化学第一次模拟考试 题型:流程题
某科研小组设计利用稀H2SO4浸取某废弃的氧化铜锌矿(主要成分为CuO和ZnO,其余成分既不与酸反应,也不溶解于水)的方案。部分实验流程如下:

已知:①H2O2、KMnO4是常见的氧化剂
②各离子开始沉淀及完全沉淀时的pH如下表所示。
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe3+ | 1.48 | 3.2 |
Zn2+ | 6.2 | 8.0 |
请根据上述实验流程回答下列问题:
(1)在“酸浸”步骤中,为提高浸出速率,除通入空气“搅拌”外,还可采取的措施是_________,写出硫酸溶解氧化锌的化学方程式为_________________。
(2)“操作1”所需要的主要玻璃仪器有______________________,固体1的成分是___________。
(3)“氧化”的目的是将Fe2+反应生成Fe3+,以便在后续的操作中将溶液中铁元素除去从产品纯度的角度分析,氧化剂最好选用_________________(填“H2O2"或“KMnO4”)。
(4)“除铁”过程中加入氨水的目的是通过调节溶液的pH,使Fe3+沉淀而Zn2+不沉淀,pH应控制在_______范围之间。
(5)某温度下,Fe(OH)3分解得到一种铁、氧质量比为21:8的氧化物,该氧化物的化式__________________。
升高温度(增大酸浓度、将氧化铜锌矿粉碎??增大表面积等) H2SO4+ZnO=ZnSO4+H2O 漏斗、烧杯、玻璃棒 铁和铜 H2O2 3.2?6.2 Fe3O4 【解析】(1)影响化学反应速率的因素有多种,要提高氧化铜锌矿的酸浸速率,可采取的措施还有升高温度(增大酸浓度、将氧化铜锌矿粉碎??增大表面积等);硫酸锌和氧化锌反应生成硫酸锌和水,化学方程式为:H2SO4+ZnO=ZnSO4+H2...查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com