
分析 (1)根据氢氧化钠能和二氧化碳反应生成碳酸钠和水进行分析;
(2)根据碳酸钠和稀硫酸反应生成硫酸钠、水和二氧化碳,根据表中提供的数据和反应的化学方程式可以进行相关方面的计算;
(3)根据浓盐酸具有挥发性进行分析.
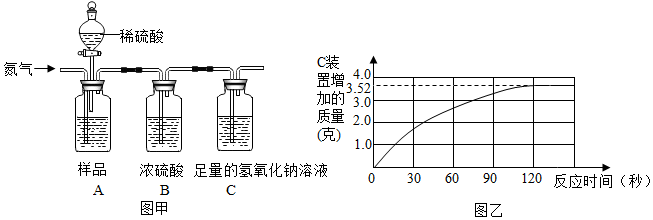
解答 解:(1)实验前,先往A装置通入一会儿氮气的目的是除去装置中的二氧化碳;故选A;
(2)设碳酸钠质量为x,
由表中数据控制,反应生成二氧化碳的质量是3.52g,
Na2CO3+H2SO4═Na2SO4+H2O+CO2↑,
106 44
x 3.52g
$\frac{106}{44}=\frac{x}{3.52g}$
x=8.48g,
则该食用纯碱中碳酸钠的质量分数是:$\frac{8.48g}{10g}$×100%=84.8%,
答:该食用纯碱中碳酸钠的质量分数是84.8%;
(3)若将稀硫酸换为浓盐酸,实验中C装置增加的质量会偏大,是因为浓盐酸易挥发,挥发出的氯化氢气体能和氢氧化钠反应;
故填:浓盐酸易挥发,挥发出的氯化氢气体能和氢氧化钠反应.
点评 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.


科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | X>Y>Z | B. | X>Z>Y | C. | Z>Y>X | D. | Y>Z>X |
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| A. | 铝与盐酸反应生成AlCl3和H2,则金属铁与盐酸反应生成FeCl2和H2 | |
| B. | 化学反应前后由于原子种类不变,所以元素种类不变 | |
| C. | 向某固体滴加稀盐酸,若有气泡产生,则固体中一定含有碳酸根 | |
| D. | 有机物一定含碳元素,含碳元素的化合物也一定是有机物 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题

| A. | ②④是同种元素 | B. | ④表示的元素是非金属元素 | ||
| C. | 它们表示四种元素 | D. | ①④表示的是阳离子 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 如图表示稀盐酸和氢氧化钠溶液发生反应过程中溶液的pH的变化,请回答下列问题:
如图表示稀盐酸和氢氧化钠溶液发生反应过程中溶液的pH的变化,请回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:计算题
| 烧杯 | 大理石 | 稀盐酸 | 反应后烧杯及其中溶液总质量 | |
| 质量(克) | 90 | 8.5 | 50 | 144.2 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A、化学与生活 | B、化学与安全 |
| ①碘酒洒在衣服上,可用酒精擦洗除去 ②用镶有金刚石的玻璃刀裁玻璃 ③银可以用来制导线 | ①炒菜锅着火可以用锅盖盖火 ②在室内一盆水能防止煤气中毒 ③夜间发现液化气泄漏开灯寻找泄漏源 |
| C、化学与资源 | D、化学与发现 |
| ①防止金属腐蚀是保护金属资源的途径之一 ②煤、石油、天然气是可再生能源 ③海洋中蕴藏着丰富的化学资源 | ①波义耳发现酸碱指示剂 ②门捷列夫发现元素周期律并编制元素周期表 ③侯德榜制碱,指的是制取纯碱 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com