
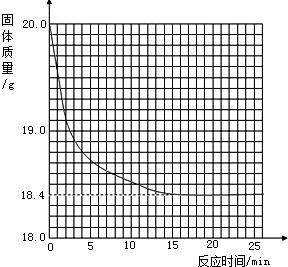
 有一黑紫色的固体为KMnO4和MnO2的混合物,为测定混合物中KMnO4的质量分数,某同学取样20.0g,对固体充分加热,测得固体质量随反应时间变化的曲线见下图.
有一黑紫色的固体为KMnO4和MnO2的混合物,为测定混合物中KMnO4的质量分数,某同学取样20.0g,对固体充分加热,测得固体质量随反应时间变化的曲线见下图.| 20.0g-M | 20.0g |
| ||
| 316 |
| 32 |
| x |
| 1.6g |
| 316×1.6g |
| 32 |
| 15.8g |
| 20g |


科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:
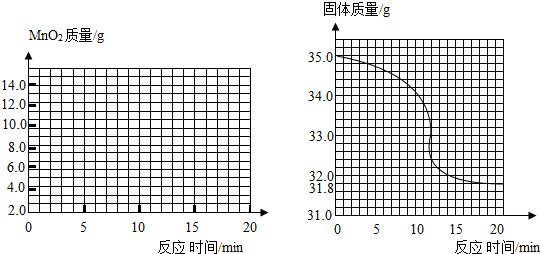
 有一黑紫色的固体为KMnO4和MnO2的混合物,为测定混合物中KMnO4的质量分数,某同学取样35.0g,对固体充分加热,并在不同时刻测定试管内剩余固体物质的质量(如下表):
有一黑紫色的固体为KMnO4和MnO2的混合物,为测定混合物中KMnO4的质量分数,某同学取样35.0g,对固体充分加热,并在不同时刻测定试管内剩余固体物质的质量(如下表):| 反应时间/min | 1.0 | 2.0 | 3.0 | 4.0 | 5.0 |
| 剩余固体质量/g | 34.2 | 33.4 | 32.6 | 31.8 | 31.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com