B
分析:A、过氧化氢在二氧化锰的催化作用下能生成水和氧气,根据催化剂的特点分析;
B、向酸性溶液中加入碱时,溶液的PH升高,直到大于7;
C、在金属活动性顺序中,位置越靠前的金属与酸反应的速率越快;根据金属的相对原子质量判断产生氢气的多少;
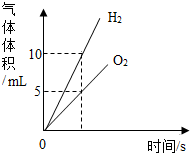
D、根据电解水时产生的氢气和氧气的体积比是2:1分析.
解答:A、向一定量过氧化氢溶液中加入少量二氧化锰,二氧化锰在反应前后其质量和化学性质保持不变,故A正确;
B、原溶液是稀盐酸,pH<7,当加入氢氧化钠与其反应,pH逐渐增大到等于7;当稀盐酸全部反应后,随着氢氧化钠增多,pH>7.图示图象是向碱中加酸.故B图象不符合;
C、在金属活动性顺序中,镁>锌,镁与酸反应生成氢气的速率大于锌;同时因金属足量,相同质量的酸液完全反应生成氢气的质量相等,故C正确;
D、水通电产生氢气和氧气的体积比是2:1,故D正确.
故选B.
点评:本题考查了常见物质的性质,完成此题,可以依据物质的性质结合具体的图象进行分析.






 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案