��2012?��ͽ����ģ��ijУ��ѧ��ȤС��ι��Ƽ���������Ϣ���������������о���
���������ϡ�
�ٸó����á������Ƽ�������Ļ�����ƷΪ������Ȼ�泥�
������ԭ�ϴ����к����������������ʣ�MgCl
2��CaCl
2�������������ʣ�
������ԭ����NaCl+NH
3+CO
2+H
2O=NaHCO
3��+NH
4Cl������þ���A����ʹ�������ȣ����ɷֽ��Ƶô�����ֳ�����������˷�Ӧ�Ļ�ѧ����ʽΪ
��
���Ȼ�立ֽ�Ļ�ѧ����ʽ��NH
4Cl
NH
3��+HCl����
�ݲ���������������ͼ��ʾ��
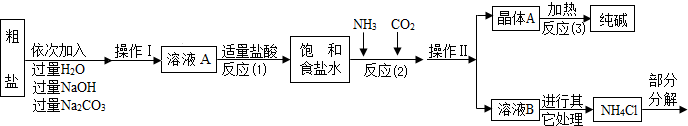
���������ۡ�
��1����ҺA�е�������NaCl��
NaOH
NaOH
��
Na2CO3
Na2CO3
�������������Ϊ
����
����
��
��2������������NaOH��Һ�������dz�ȥ�����е�
MgCl2
MgCl2
��
��3�������Na
2CO
3��Һ��������Ӧ�Ļ�ѧ����ʽ
Na2CO3+CaCl2=CaCO3��+2NaCl
Na2CO3+CaCl2=CaCO3��+2NaCl
��
��4���������������п�ѭ��ʹ�õ���
ABC
ABC
������ţ���
A��CO
2 B��NH
3 C��HCl D��NaOH
��5������������Ϣ���������ʵ������̼���ƺ�̼�����ƣ�
| ʵ�鲽�� |
ʵ������ |
ʵ����� |
ȡ������Ʒ�е�һ�ַ����Թ��У����ϴ����ܵĵ�������������һ���������ʯ��ˮ�У����ȹ��岢�۲����� ȡ������Ʒ�е�һ�ַ����Թ��У����ϴ����ܵĵ�������������һ���������ʯ��ˮ�У����ȹ��岢�۲����� |
������ɫ���ݣ�����ʯ��ˮ����� ������ɫ���ݣ�����ʯ��ˮ����� |
����Ʒ��NaHCO3������Na2CO3 ����Ʒ��NaHCO3������Na2CO3 |
�����ȷ����
��ȡһ�������Ĵ�����Ʒ������γ�ּ��Ⱥ��ٳ��أ������ޱ仯��
��ȡ����������Ʒ��������ˮ����Ʒ��ȫ�ܽ⣬�����Һ�м������ϡHNO
3���ٵμ�AgNO
3��Һ���а�ɫ������
��6��������ʵ���ȷ��������Ʒ��������
NaCl
NaCl
��д��ѧʽ����
�������ⶨ��
ͬѧ��Ϊ�˲ⶨ�ô�����Ʒ�Ĵ��ȣ��ٶ�ֻ�У�6���е����ʣ������������ʵ�飺
��7������ʵ�飺ȡ10.0g������Ʒ�������м�����������ᣬֱ����Ʒ��������ð������ּ��������������ʲ������ȴ�����º���������ù�������Ϊ10.9g��������Ʒ��̼���Ƶ���������Ϊ��д��������̣��������һλС������
86.7%
86.7%

��8������ʵ�飺ȡ10.0g������Ʒ��������ͼ��ʾװ�ã������Ӧ��װ��C������3.5g�������Լ�����������ʵ�������������ⶨ��̼������������ƫС����ԭ����
���ɵĶ�����̼����û����ȫ��C�е��ռ�����
���ɵĶ�����̼����û����ȫ��C�е��ռ�����
��







 �ƣ���ʵ����ͨ���ÿ�״������������FeS����ϡ�����ϣ��ڳ����·�����Ӧ�Ƶ�H2S��ijͬѧ����ͼF��G��Hװ��������ռ�H2S���壮
�ƣ���ʵ����ͨ���ÿ�״������������FeS����ϡ�����ϣ��ڳ����·�����Ӧ�Ƶ�H2S��ijͬѧ����ͼF��G��Hװ��������ռ�H2S���壮
 ��2012?��ͽ����ģ����ͼ��ʾװ���У���ͷ�ι��������Һ�壬ƽ����ƿ�г��루����룩�����ʣ���ѹ��ͷ�ιܣ�һ��ʱ���װ���е����������ʹ�������������ʿ����ǣ�������
��2012?��ͽ����ģ����ͼ��ʾװ���У���ͷ�ι��������Һ�壬ƽ����ƿ�г��루����룩�����ʣ���ѹ��ͷ�ιܣ�һ��ʱ���װ���е����������ʹ�������������ʿ����ǣ�������