
| 氢氧化物 | 溶液pH | |||
| 开始沉淀 | 沉淀完全 | 沉淀开始溶解 | 沉淀完全溶解 | |
| Fe(OH)3 | 2.3 | 3.4 | 沉淀不溶 | 沉淀不溶 |
| Al(OH)3 | 3.3 | 5.2 | 7.8 | 12.8 |
| Mg(OH)2 | 8.6 | 11.1 | 沉淀不溶 | 沉淀不溶 |

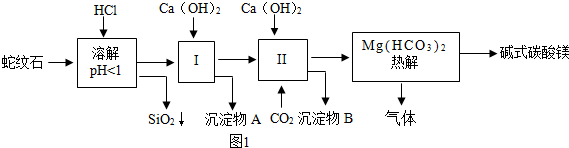
分析 (1)蛇纹石矿可以看做MgO、Fe2O3、Al2O3、SiO2组成,蛇纹石加盐酸溶解后,MgO、Fe2O3、Al2O3和HCl反应溶解,而SiO2和HCl不反应,不能溶解;
(2)根据题干中沉淀形成和溶解的pH信息来分析;
(3)根据化学方程式的写法来分析;
(4)根据反应过程中CO2既是反应物,也是生成物,可以重复使用进行分析;
(5)①根据氢氧化钠固体的化学性质和浓硫酸的吸水性进行分析;根据装置中的空气中含有二氧化碳和水蒸气进行分析;
②根据硬质玻璃管中剩余的固体质量为2.0g,C处浓H2SO4增重0.9g,D处碱石灰增重1.76g进行分析;根据碱石灰可以吸收空气中的二氧化碳和水蒸气进行分析.
解答 解:(1)蛇纹石加盐酸溶解,MgO、Fe2O3、Al2O3和HCl反应溶解,反应方程式分别为:MgO+2HCl=MgCl2+H2O,Fe2O3+6HCl=2FeCl3+3H2O,Al2O3+6HCl=2AlCl3+3H2O.而SiO2不与盐酸反应,以沉淀的形式除去.故答案为:3;MgO+2HCl=MgCl2+H2O;
(2)根据题干中沉淀形成的pH可知,当溶液pH=6~7时,氢氧化铁和氢氧化铝会沉淀析出;若Ca(OH)2过量,溶液pH会升高,pH超过7.8时,氢氧化铝沉淀开始溶解,到达8.6时,氢氧化镁沉淀形成;故填:Fe(OH)3、Al(OH)3;Al(OH)3;Mg(OH)2;
(3)碳酸氢镁受热分解为氧化镁、二氧化碳和水,故填:Mg(HCO3)2$\frac{\underline{\;\;△\;\;}}{\;}$MgO+2CO2↑+H2O;
(4)从实验步骤图知:上述实验中,步骤Ⅱ中通二氧化碳,生成碳酸钙,碳酸钙分解可得到二氧化碳,作为第Ⅱ步的原料,碱式碳酸镁分解得到CO2,可以循环使用的物质是:CO2;故答案为:CO2;
(5)①氢氧化钠溶液可以吸收空气中的二氧化碳,避免对后面检验二氧化碳、水造成干扰,所以A框中装置的作用是:除去空气中的二氧化碳;B中的浓硫酸具有吸水性,是为了除去空气中的水蒸气;故填:除去空气中的二氧化碳;除去空气中的水蒸气;使得碱式碳酸镁分解产生的二氧化碳和水蒸气被完全排出;
②硬质玻璃管中剩余的固体质量为2.0g,C处浓H2SO4增重0.9g,所以m(H2O)=0.9g,D处碱石灰增重1.76g,所以m(CO2)=1.76g,
mMgCO3nMg(OH)2xH2O$\frac{\underline{\;高温\;}}{\;}$(m+n)MgO+mCO2↑+(n+x)H2O↑,
80(m+n) 44m 18(n+x)
2g 1.76g 0.9g
$\frac{80(m+n)}{2g}=\frac{44m}{1.76g}=\frac{18(n+x)}{0.9g}$
解之得:m=4,n=1,x=4,
所以碱式碳酸镁的化学式为:4MgCO3•Mg(OH)2•4H2O;
装置F去掉,空气中的二氧化碳和水蒸气会增加碱石灰和浓硫酸的质量,所以对实验结果的影响是m值偏大,x值偏大;故填:4:1;4;偏大.
点评 本题主要考查了元素化合物中金属铝、铁的性质,解题时不仅需熟知物质间的反应原理,还需灵活运用于实验的设计,难度较大.


科目:初中化学 来源: 题型:填空题
 教科书上《分子和原子》一课中,安排有氨水挥发证明分子运动的探究实验.小茜同学很讨厌氨水味,在老师的帮助下设计了如图的探究分子运动的实验装置,请回答下列各题:
教科书上《分子和原子》一课中,安排有氨水挥发证明分子运动的探究实验.小茜同学很讨厌氨水味,在老师的帮助下设计了如图的探究分子运动的实验装置,请回答下列各题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 为测定某赤铁矿石中氧化铁的质量分数,龙林和他的同学用足量的一氧化碳与10g赤铁矿石样品充分反应(杂质不参与反应),并将生成的气体用一定量的氢氧化钠溶液完全吸收,该溶液总质量与反应时间的变化关系如图.
为测定某赤铁矿石中氧化铁的质量分数,龙林和他的同学用足量的一氧化碳与10g赤铁矿石样品充分反应(杂质不参与反应),并将生成的气体用一定量的氢氧化钠溶液完全吸收,该溶液总质量与反应时间的变化关系如图.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 将过量稀盐酸逐滴加入到12.5g水垢粉末中,称量下图装置6分钟内减轻的质量,结果表示如下:
将过量稀盐酸逐滴加入到12.5g水垢粉末中,称量下图装置6分钟内减轻的质量,结果表示如下:| 时间/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
| 减少的质量/g | 0 | 2.2 | 3.2 | 3.8 | 4.2 | 4.4 | 4.4 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 图为黑龙江省农科院种植的玉米,请填写下列空白:
图为黑龙江省农科院种植的玉米,请填写下列空白:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com