
分析 (1)根据质量守恒定律可知参加化学反应的各物质质量总和等于反应后生成的各物质质量总和,即参加反应的A和B的质量和跟生成C和D的质量和相等;
(2)根据质量守恒定律,反应物的总质量等于生成物的总质量;
(3)根据Z与W的相对质量之比及反应中Z与W物质的分子个数关系,计算出参加反应中两物质的质量关系;根据Z与W物质的质量关系,由生成W的质量计算出生成Z物质的质量;最后使用质量守恒定律,求得参加反应的Y物质的质量,即可计算出Y与W的质量比.
解答 解:(1)由质量守恒定律,生成C和D共140g,则参加反应的A和B的质量之和也为140g,而A、B两物质完全反应时的质量比为3:4,故反应消耗B的质量是140g×$\frac{4}{3+4}$=80g;故填:80g;
(2)根据质量守恒定律,2×24+32×2=2×Z的相对分子质量,则Z的相对分子质量为56.故填:56;
(3)根据“Z与W相对分子质量之比为9:22”,则假设Z与W相对分子质量分别为9、22,
设生成8.8gW同时生成Z的质量为x,
2X+5Y=2Z+4W
2×9 4×22
x 8.8g
$\frac{18}{88}=\frac{x}{8.8g}$
x=1.8g
根据质量守恒定律参加反应的Y的质量为1.8g+8.8g-2.6g=8g,则Y与W的质量比为8g:8.8g=10:11.故填:10:11
点评 本道题主要考查了有关质量守恒定律的应用,解本题的关键是反应物的相对分子质量总和与生成物的相对分子质量总和相等.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| A. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | B. | HCl+NaOH═NaCl+H2O | ||
| C. | CO+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2 | D. | Fe+CuSO4=Cu+FeSO4 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
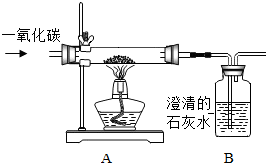 某同学使用如图所示装置,试验一氧化碳与磁铁矿的反应.请回答下列有关问题:
某同学使用如图所示装置,试验一氧化碳与磁铁矿的反应.请回答下列有关问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com