
【题目】氯化氢(HCl)是极易溶于水的无色气体,其水溶液叫盐酸。
(1)增大压强, HCl由气态变为液态, 从微观的角度分析该变化过程中改变的是____。
(2)在盐酸中加入过量的铁粉充分反应。如图表示该反应前后溶液中存在的主要离子,请写出每种图形代表的离子(填离子符号):
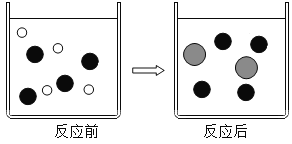
![]() _____、
_____、![]() ____、
____、![]() ____。
____。
(3)取 2 支试管,分别开展如下实验:
实验 I:在充满 HCl 气体的试管中放入用石蕊染成紫色的干燥纸条,无明显现象;再滴入水。
实验 II:在充满CO2气体的试管中放入用石蕊染成紫色的干燥纸条,无明显现象;再滴入水。
实验 I 和实验 II 滴入水后的现象为:_______。
(4)向盛有Na2CO3粉末的试管中通入 HCl 气体,无明显现象;停止通气,再加入少量水,现象是___________,写出该反应的化学方程式_____。
(5)结合(3)与(4)中有关的实验与现象,下列有关 HCl 气体和盐酸中说法正确的是: _____
a.HCl 气体和盐酸具有完全相同的化学性质;
b.HCl 气体中含有氢离子;
c.向盛有CaCO3固体的试管中滴入稀盐酸,能放出使澄清石灰水变浑浊的气体;
d.HCl 气体和CO2气体通入水后均产生了氢离子
【答案】分子的间隔 H+ Cl- Fe2+ 染有石蕊的纸条变红色 白色粉末溶解,溶液中气泡逸出(没有写粉末溶解不扣分) ![]() cd
cd
【解析】
根据物质的三态变化是分子间间隔的改变,利用酸的电离及酸的通性相关知识进行作答。
(1)增大压强, HCl由气态变为液态,是物理变化,分子本身是不变的,只是分子间的间隔变小;
(2)在盐酸中加入过量的铁粉充分反应。其反应化学方程式是:![]() 。反应前盐酸溶液中的离子是H+、Cl-,反应后溶液中的离子是Cl-、Fe2+,反应前后是Cl-都有,对照图片:
。反应前盐酸溶液中的离子是H+、Cl-,反应后溶液中的离子是Cl-、Fe2+,反应前后是Cl-都有,对照图片:![]() 是Cl-,则
是Cl-,则![]() 是H+、
是H+、![]() 是Fe2+;
是Fe2+;
(3)实验 I:在充满 HCl 气体的试管中放入用石蕊染成紫色的干燥纸条,无明显现象,因为氯化氢气体中没有氢离子和氯离子,不是酸;再滴入水,氯化氢气体极易溶于水,形成了盐酸,产生了H+、Cl-,所以盐酸使染有石蕊的纸条变红色;
实验 II:在充满 CO2 气体的试管中放入用石蕊染成紫色的干燥纸条,无明显现象,因为二氧化碳不是酸;再滴入水,CO2和水发生反应生成碳酸,碳酸使染有石蕊的纸条变红色;
(4)向盛有 Na2CO3 粉末的试管中通入 HCl 气体,无明显现象,因为氯化氢气体中没有氢离子和氯离子,不是酸;停止通气,再加入少量水,氯化氢气体极易溶于水,产生了H+、Cl-,形成了盐酸,则盐酸与Na2CO3反应产生大量的气泡,同时Na2CO3 粉末减少至消失,该反应的化学方程式;![]() ;
;
(5)结合(3)与(4)中有关的实验与现象,进行
a.HCl 气体是分子构成的,盐酸中含有的是H+、Cl-,结构不同,化学性质不同,不符合题意;
b.HCl 气体是氯化氢分子构成的,不符合题意;
c.CaCO3 固体中滴入稀盐酸,两者反应:![]() ,二氧化碳能使澄清石灰水变浑浊,符合题意;
,二氧化碳能使澄清石灰水变浑浊,符合题意;
d.HCl 气体溶于水,形成了盐酸,产生了H+、Cl-,CO2 气体通入水后,CO2和水发生反应生成碳酸,碳酸电离产生了H+,符合题意。故选cd。


科目:初中化学 来源: 题型:
【题目】在化学实验室开放日,老师拿出两瓶无标签的试剂,分别是固体和液体,他取少量试剂在试管中混合,立即产生一种无色气体。同学们对此气体展开了一系列探究。
(1)如果推测此气体是二氧化碳,验证它的实验方案如下:
猜想 | 实验步骤 | 现象与结论 |
此气体可能是CO2 | __________ | __________ |
产生此气体的化学方程式可能是__________。
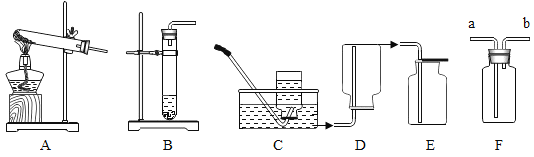
(2)若想制取该气体,采用的发生装置可选取下图中的____(填序号),如用下图中F装置收集该气体,气体应由____ (选填“a”或“b”)端导入。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】工业上进行金属切割或焊接时常使用到氧炔焰(乙炔在氧气中燃烧产生的火焰)。
(1)化学反应常伴随有能量变化,乙炔燃烧是化学能转化为____能;
(2)乙炔不充分燃烧,会产生____和水,可见乙炔不充分燃烧既浪费燃料又污染环境,为了使乙炔充分燃烧,你的做法是____;
(3)在点燃乙炔(C2H2)前,必须____,以防止发生爆炸,请写出C2H2充分燃烧的化学方程式____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】现有盐酸和CaCl2的混合溶液,向其中逐滴滴入Na2CO3,溶液,生成沉淀质量与滴入Na2CO3溶液质量的变化关系如图所示,下列说法不正确的是( )

A.反应过程中先冒气泡,后产生白色沉淀
B.滴至bg时,溶液中的含HCl、NaCl两种溶质
C.滴至cg时,溶液恰好完全反应
D.滴至dg时,溶液pH>7
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某同学为了测定石灰石中钙元素的含量(假设石灰石中除CaCO3含钙元素外,杂质不含钙元素、且不溶于水、不与酸反应),进行如下实验:称取20g石灰石样品放入烧杯中,将80g稀盐酸分4等份,分4次加入烧杯中,充分反应后称量。所得数据如下:
次 数 | 1 | 2 | 3 | 4 |
每次加入稀盐酸的质量/g | 20 | 20 | 20 | 20 |
充分反应后烧杯中物质的质量/g | 37.8 | 55.6 | 74.5 | 94.5 |
(1)充分反应后共生成CO2的质量为__________g。
(2)求样品中含CaCO3的质量_______(列化学方程计算)。
(3)该石灰石中钙元素的质量分数为____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】元素周期表是学习和研究化学的重要工具,下图是元素周期表的部分内容及碳原子的结构示意图,完成相关问题。
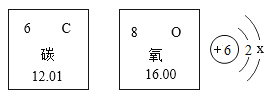
(1)碳元素的相对原子质量是_____;x的数值为_____。
(2)碳、氧两种元素的本质区别是_____不同,二者能组成一种产生温室效应的气体,其化学式为______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】取一定质量的铜和氧化铜的混合物,在空气中充分灼烧,使铜全部转化为氧化铜,消耗氧气8g。向灼烧后的固体中加入稀硫酸至固体恰好完全反应,制得800g质量分数为20%的硫酸铜溶液。
(1)利用化学方程式计算原混合物中铜的质量。
(2)计算原混合物中铜元素的质量分数(计算结果保留至 0.1%)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在一定条件下,甲和乙反应生成丙和丁,微观变化示意图如图。下列说法正确的是( )
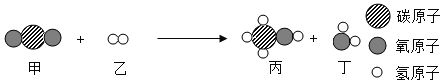
A.该反应为置换反应
B.丙的相对分子质量为32
C.参加反应的甲和乙的分子个数比为1:1
D.丁中H、O元素的质量比为1:16
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】工业上常用石英砂(主要成分是SiO2)和焦炭等制备高纯硅,如图 是其生产流程示意图。

(1)“精馏”是蒸馏的一种形式,该过程属于 ___变化(选填“物理”、“化学”)。
(2)反应②属于的基本反应类型是 ___。
(3)反应③中若混入O2可能引起的安全事故是 ___。为了达到绿色化学和资源综合利用的目的,在生 产过程中物质 Y 需要循环使用,则 Y 的化学式为 ___。
(4)反应①中焦炭过量,X 是种气体。①中主要反应的化学方程式为 ___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com