
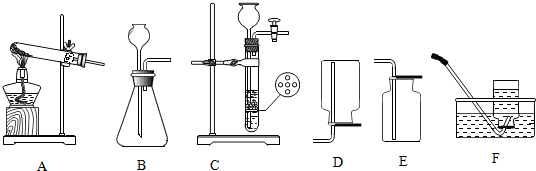
分析 (1)用装置A、G制取氧气,从选择合适的发生装置和收集装置看,属于“固体加热型”,排水法收集氧气(氧气不易溶于水),据此分析作答.
(2)实验室用大理石和稀盐酸反应制取CO2气体,生成物为氯化钙、水和二氧化碳,C装置可控制反应随时发生随时停止,密度比空气大且能溶于水的气体可用向上排空气法收集;
(3)用加热氯化铵和氢氧化钙的固体混合物来制取氨气,因为反应物为固体,反应条件需要加热,所以应选用“固固加热型”发生装置.
解答 解:(1)用装置A、G制取氧气,从选择合适的发生装置和收集装置看,属于“固体加热型”,可用加热高锰酸钾的方法制取氧气,排水法收集氧气(氧气不易溶于水),制取氧气化学方程式为:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,实验结束后要先将导管移出水面,后熄灭酒精灯的原因是:防止水槽里的水倒吸入试管使试管炸裂;
(2)实验室用大理石和稀盐酸反应制取CO2气体,生成物为氯化钙、水和二氧化碳,化学方程式是:CaCO3+2HCl═CaCl2+H2O+CO2↑;与B装置相比,使用带有多孔隔板C装置的优点是:可控制反应随时发生随时停止;只能用E装置向上排空气法收集CO2气体的原因是:二氧化碳的密度比空气大,能与水反应;
(3)用加热氯化铵和氢氧化钙的固体混合物来制取氨气,因为反应物为固体,反应条件需要加热,所以应选用“固固加热型”发生装置,应选用的发生装置是A;理由是:反应物为固体,反应条件需要加热.
故答案为:
(1)2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;防止水槽里的水倒吸入试管使试管炸裂;
(2)CaCO3+2HCl═CaCl2+H2O+CO2↑;可控制反应随时发生随时停止;二氧化碳的密度比空气大,能与水反应;
(3)A;反应物为固体,反应条件需要加热.
点评 主要考查了常用气体的发生装置和收集装置与选取方法,实验室制取氧气和二氧化碳的反应原理和实验装置要掌握,这是两个比较典型的实验,具有代表性,常用的化学方程式要牢记.
实验室制取气体的发生装置应根据反应物的状态和反应发生的条件来确定.一般分为两种:①固体与固体反应生成气体,反应需要加热,简称“固固加热型”,选择实验室制取O2的发生装置;②固体与液体反应生成气体,反应不需要加热,简称“固液不加热型”,选择实验室制取H2或CO2的发生装置.
实验室制取气体的收集装置要根据所收集的气体的密度大小、是否溶于水来判断其收集方式以及收集装置,一般情况下,不溶于水的采用“排水法”,密度比空气大的可用“向上排空气法”,密度比空气小的可用“向下排空气法”来收集气体.


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:初中化学 来源: 题型:解答题
 空气中氧气含量测定的再认识.
空气中氧气含量测定的再认识.| 测量项目 | 实验前 | 实验后 | |
| 烧杯中水的体积 | 烧杯中剩余水的体积 | 集气瓶(扣除内容物)和导管的容积 | |
| 体积/mL | 80.0 | 54.5 | 126.0 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 根据质量守恒定律,回答下列问题.Ⅰ、为验证质量守恒定律,某同学设计了如图的实验.
根据质量守恒定律,回答下列问题.Ⅰ、为验证质量守恒定律,某同学设计了如图的实验.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
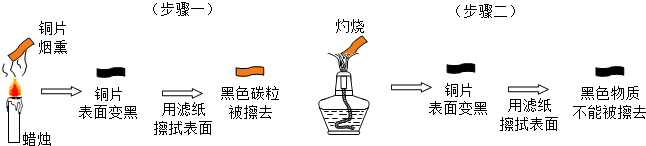
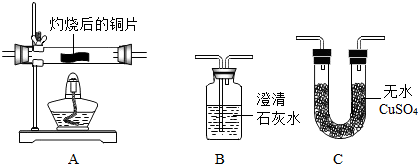
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com